
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм диссоциации
|
|
|
|
Теория электролитической диссоциации
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. В связи с этим все вещества делят на электролиты и неэлектролиты.
Электролиты – вещества, растворы и расплавы которых проводят электрический ток за счет распада на ионы (вещества, распадающиеся на ионы в растворах или расплавах и поэтому проводящие электр. ток).
Неэлектролиты – вещества, растворы и расплавы которых не проводят эл.ток (или в-ва, которые в тех же условиях на ионы не распадаются и эл.ток не проводят).
Электролиты – кислоты, основания, почти все соли – р-ры NaCl, H2SO4.
Неэлектролиты – большинство органических соединений, в-ва с ков.непол. и малополярной связью – ацетон, сахар, спирт.
Электролиты являются проводниками второго рода, т.к.проводят эл.ток в р-те распада на ионы. Проводниками первого рода являются металлы.
Все имеющиеся данные о распаде электролитов на ионы, предположения были развиты в стройную теорию, получившую название теории электролитической диссоциации. Теория электролитической диссоциации была предложена Сванте Аррениусом.
Электролитическая диссоциация – распад электролитов на ионы при растворении их в воде или расплавлении. Содержание этой теории можно свести к следующим положениям:
1. Все электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на заряженные частицы – ионы.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду („ - ” заряженному электроду) и называются катионами, а отрицательно заряженные ионы – аноду („ + ” заряженному электроду) и называются анионами.
Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
3. Свойства атомов и ионов одного и того же элемента различны.
Сu o - вещество красного цвета
Сu 2+ - бесцветный
Сu 2+ · 4Н2О - голубой
Cl o 3s2 3p5 - Cl2 – газ, желто-зеленого цвета, ядовитый с резким запахом
Сl - 3s2 3p6 - бесцветный, без запаха
Почему электролиты распадаются на ионы?
Вещества с ионной связью:
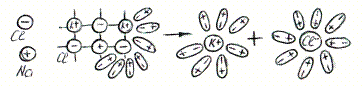
Между ионами и диполями воды возникают силы взаимного притяжения В р-те
связь между ионами ослабевает, происходит переход ионов из кристалла в раствор, образуются гидратированные ионы.
Вещества с полярной связью: СН3СООН
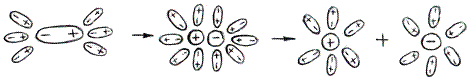
Полярная молекула под действием диполей воды поляризуется еще больше, так что электронная пара полностью переходит к атому с большей электроотрицательностью и превращается в ионную связь, затем образуются гидратиров. ионы. Т.е. электролитами являются вещества с ионной или полярн. ков. связью - соли, основания, кислоты. И диссоциируют они на ионы в полярных растворителях – воде, аммиаке жидком и т.д.
Теория, созданная Аррениусом, рассматривала ионы без влияния или действия молекул растворителя. В это же время Менделеев подтвердил взаимодействие раствор.
вещества с молекулами растворителя. Получалось, что существует 2 теории, противоположные друг другу. Объединил эти теории И.А.Каблуков.
Каблуков предложил, что именно гидратация – основная причина диссоциации вещества на ионы. В растворе существуют только гидратированные ионы:
Н+ (Н3О = Н+ ·Н2О) ион гидроксония.
Т.к. большинство гидратированных ионов переменного состава, то для простоты пишут либо Cl ‾aq, либо Cl ‾.
С помощью теории электролитической диссоциации описывают свойства кислот, оснований и солей.
Кислоты – электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка (или при диссоциации которых в качестве катионов образуются только катионы водорода).
HCl → H+ + Cl ‾
Двух - и многоосновные кислоты диссоциируют ступенчато.
H2SO4 → H+ + HSO4‾
Диссоциация лучше всего идет по
HSO4 ‾ ↔ H+ + SO42 ‾ I ступени
Основания – электролиты, при диссоциации которых в качестве анионов образуются только гидрооксид – ионы.
КОН → К+ + ОН ‾ NH4OH ↔ NH4+ +OH ‾
Двух - и многокислотные основания диссоциируют ступенчато.
Са (ОН)2 → СаОН + + ОН ‾
СаОН + ↔ Са 2+ + ОН ‾
Соли - электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Средние соли: Na2SO4 → 2Na + + SO4 2 ‾ электролиты сначала диссоциируют
по ионн. св., а уже затем по ков.
Кислые соли: KHSO4 → K + + HSO4 ‾ полярн.связи
HSO4 ‾ ↔ H + + SO4 2 ‾
Основные соли: MgOHCl → MgOH + + Cl ‾
MgOH + ↔ Mg 2+ + OH ‾
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 5812; Нарушение авторских прав?; Мы поможем в написании вашей работы!