
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетические методы анализа
|
|
|
|
Кинетические методы анализа основаны на использовании зависимости скорости химической реакции от концентрации реагирующих веществ и от концентрации катализатора (если реакция каталитическая).
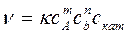
где к – константа скорости кат реакции;
с - концентрации реагирующих веществ и катализатора соответственно.
Аналитическим сигналом в кинетических методах является скорость процесса и пропорциональная ей величина.
Реакция, положенная в основу кинетического метода, называется индикаторной. Вещество, по изменению концентрации которого судят о скорости индикаторного процесса - индикаторным.
Пример индикаторной реакции:
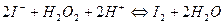
Индикаторным веществом при этом могут быть пероксид водорода или йод за изменением концентраций которых могут быть использованы титриметрический или спектрофотометрические методы.
Требования к индикаторным реакциям:
- за время наблюдения практически не должна меняться концентрация определяемого компонента (если определяемым является одно из реагирующих веществ, то с достаточной точностью его можно определять в тот начальный период реакции, когда его концентрация изменилась не более, чем на 5 %);
- наличие простого, доступного метода наблюдения за скоростью индикаторного процесса (за изменением концентрации индикаторного вещества);
- скорость индикаторной реакции должна находиться в оптимальных пределах (5-15 мин, но с развитием метода начали использовать и с большей скоростью ~ 10 с.)


С2 С1 С3


C1 C2 C3

t3 t2 t3 C1 C2 C3

Способы определения неизвестной концентрации вещества по данным кинетических измерений.
Если индикаторным веществом будет продукт реакции «с» и его текущую концентрацию обозначить через «x», то скорость реакции можно выразить:

Для случаев, когда изменения концентраций А и В за время наблюдения не наблюдается (например при начальной стадии реакции), проинтегрировав данное уравнение получим


Кинетический метод, основанный на использовании данного уравнения, когда наблюдается линейная зависимость между концентрацией индикаторного вещества и временем, называют дифференцированным вариантом.
В случае, если наблюдается изменение концентрации хотя бы одного из реагирующих веществ, то зависимость между величинами «с» и «t» будет более сложная. Такой вариант называют интегральным.
Характер кинетических кривых, а следовательно, и использование дифференциального или интегрального вариантов определяется типом индикаторной реакции, ее механизмом.
Рассмотрим для дифференциальног варианта три основных способа определения неизвестной концентрации вещества по данным кинетических измерений
Способ тангенсов (наиболее часто применяемый способ) предусматривает построение кинетических кривых при известных концентрациях определяемого вещества.
tg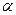 характеризует при этом скорость индикаторной реакции
характеризует при этом скорость индикаторной реакции  и зависит от концентрации определяемого вещества. Строят градуировочный график в координатах: концентрация определяемого вещества- tg
и зависит от концентрации определяемого вещества. Строят градуировочный график в координатах: концентрация определяемого вещества- tg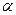 .(рис. первый).
.(рис. первый).
По способу фиксированного времени протекания реакции определяют концентрацию индикаторного вещества в пробах, содержащих разные, известные количества определяемого соединения. Градуировочный график строят в координатах – концентрация определяемого соединения - концентрация индикаторного вещества, определенная при фиксированном времени. (второй рисунок).
В способе фиксированной концентрации в отдельных пробах, содержащих известные концентрации определяемого соединения, проводят индикаторную реакцию до строго фиксированной концентрации индикаторного вещества хфиксир. Градуировочный график строят в координатах концентрация определяемого соединения – величина, обратная времени достижения фиксированной концентрации (третий рисунок).
Аналитические характеристики кинетических методов нужно рассматривать раздельно для их каталитического и некаталитического вариантов. Если определяемым является одно из реагирующих веществ индикаторной реакции, то это некаталитический вариант.
Если определяется катализатор или соединения, взаимодействующие с катализатором, то это - каталитический вариант, часто выделяемый в самостоятельную область, получившую название каталитические методы.
Кинетические методы, при условии строгого соблюдения условий проведения анализа, не уступают другим методам по точности, достаточно экспрессны, легко поддаются автоматизации. В практике аналитической химии эти методы применяют при анализе смесей близких по свойствам органических соединений (некаталитический вариант), определения микроколичеств металлов. Каталитические методы используют в анализе промышленных, биологических объектов и объектов окружающей среды ООС.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 834; Нарушение авторских прав?; Мы поможем в написании вашей работы!