
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 2. Липиды, синтезированные в печени (эндогенные), транспортируются в форме лпонп и ЛПВП
|
|
|
|
Одновременно в печени интенсивно протекает синтез липидов из изначальных субстратов (уксусной кислоты, глицерола, жирных кислот и т.д.). Транспорт новосинтезированных липидов из печени в кровь, а оттуда - к органам и тканям осуществляют два других типа липопротеиновых частиц, формирующихся в печени - липопротеины очень низкой плотности (ЛПОНП) и липопротеины высокой плотности (ЛПВП). Принципы устройства этих частиц аналогичны таковым у хиломикронов. Разница состоит в том, что размеры ЛПОНП и ещё более - ЛПВП меньше, чем у хиломикронов. Доля белкового компонента в их составе выше (10,4% и 48,8% от массы частицы соответственно), а содержание триацилглицеролов - ниже (31,4% и 1,8% от массы соответственно). Вследствие этого плотность ЛПОНП и ЛПВП выше, чем у хиломикронов.
Ферменты обмена липопротеинов
| Фермент | Источник | Функция |
| Липопротеинлипаза (ЛПЛ) | адипоциты миоциты | Частичное разрушение ХМ и ЛПОНП посредством высвобождения жирных кислот (ЖК) из ТАГ и ФЛ |
| Печеночная липаза | гепатоциты | Высвобождение ЖК из ТАГ, ФЛ в составе ЛППП и ЛПВП |
| Лецитин-холестерол-ацилтрансфераза (ЛХАТ) | гепатоциты | Необходим для обратного транспорта холестерола; осуществляет эстерификацию холестерола за счет переноса жирной кислоты с лецитина на СХ |
Липопротеины, содержащие апо В-100. Главным липидным компонентом ЛПОНП являются триацилглицеролы. Однако, в отличие от хиломикронов, эти триацилглицеролы синтезируются в клетках печени. Поэтому они называются эндогенными, в то время как в составе хиломикронов - экзогенными (поступившими с пищей). Основной функцией липопротеинов, содержащих апо В, является транспорт ТАГ из печени к периферическим тканям, особенно в жировую и мышечную. Для синтеза ЛПОНП в гепатоцитах требуется апо В 100, ЭХ, ТАГ и ФЛ.
Апо В-100 - это большой гидрофобный белок (4536 аминокислотных остатков), который синтезируется в печени. На его долю приходится 30-40% от общего количества белка в составе ЛПОНП и >95% белка ЛПНП. Сборка липопротеинов, содержащих апо В-100, идет в эндоплазматическом ретикулуме; каждая частица ЛПОНП содержит один апо В-100.
Триацилглицеролы для ЛПОНП синтезируются путем эстерификации жирных кислот, поступающих в гепатоциты из плазмы крови (источником их является, например, липолиз в жировой ткани) или синтезирующихся de novo в печени. Уровень синтеза ЛПОНП регулируется также наличием холестерола, в особенности, образованием эфиров холестерола под действием ацил~КоА: холестеролацилтрансферазы (АХАТ). Этот фермент локализован в эндоплазматическом ретикулуме близко к месту синтеза ЛПОНП. Его функцией является образование эфиров холестерола.
Сборка ЛПОНП регулируется на уровне посттрансляции за счет контроля наработки апо В-100. Значительное количество этого белка подвергается разрушению; такой контроль на уровне посттрансляции тесно взаимосвязан с обменом липидов в печени. Дело в том, что единственным видом липидов, которые сразу образуют стабильный комплекс с апо В, являются фосфолипиды. Только комплекс апо В с ФХ обладает способностью проходить через мембрану эндоплазматического ретикулума. Ассоциация апо В с ФХ сразу после трансляции обеспечивает возможность образования развернутой структуры белковой молекулы, необходимой для прохождения через мембрану. В случае, если этого комплексирования не происходит, апо В не может пройти через мембрану, и он неизбежно подвергается разрушению в эндоплазматическом ретикулуме.
Другие липиды выступают в качестве регуляторов образования и секреции липопротеинов. Так количество жирных кислот, подвергшихся всасыванию в кишечнике или синтезировавшихся de novo, влияет на уровень образования ТГ, их использования для сборки ЛП. Влияние на секрецию состоит не только в увеличении количества секретируемых липопротеиновых частиц. У вновь образованных ЛПОНП может существенно варьировать размер ядра. Наряду с ядерной частью ЛП нарастает и поверхностный монослой, так как параллельно ТГ увеличивается синтез ФЛ.
В регуляции сборки ЛПОНП чрезвычайно важную роль играют фосфатидилхолины. Об этом свидетельствует тот факт, что у животных с дефицитом холина развивается так называемое жировое перерождение печени. Это такое состояние, когда клетки печеночной ткани переполняются ТГ в результате блокирования секреции ЛП, обогащенных этими липидами. Примечательно, что блокируется секреция только ЛПОНП, в то время как секреция ЛПВП не изменяется. Внесение холина в питательную среду для культивирования гепатоцитов, выделенных у крыс с дефицитом холина, восстанавливала способность к образованию и секреции ЛПОНП. Холин необходим не только для синтеза ФХ, но и для образования апо В.
Апопротеины ЛПОНП. Все белки, которые входят в состав липопротеинов, на пути своего образования проходят схожие этапы. Они сводятся к следующим процессам: 1) трансляция мРНК на рибосомах; 2) перемещение через эндоплазматический ретикулум; 3) посттрансляционная модификация - процессинг (образование дисульфидных мостиков, гликозилирование, фосфорилирование); 4) сборка в транспортные формы; 5) секреция из клетки. Новосинтезированная частица ЛПОНП содержит одну молекулу апо В-100. Апо С-II, апо С-III и апо Е поступают на неё от ЛПВП после того, как ЛПОНП попадают в плазму крови. Они требуются для ускорения метаболизма ЛПОНП. Для лучшего понимания образования ЛПОНП на рис… представлена схема процессов, происходящих в клетках печени.
Обмен ЛПОНП. ЛПОНП секретируются из печени в кровь. На эндотелии сосудистой стенки в периферических тканях ТАГ в составе ЛПОНП, как и в случае ХМ, подвергаются действию фермента ЛПЛ. Необходимым кофактором для проявления активности ЛПЛ является апо С-II. Высвобождающиеся жирные кислоты поступают в клетки органов и тканей.
В дополнению к обмену апопротеинами за счет ЛПОНП формируется поверхностный монослой ЛПВП. У ЛПОНП он становится избыточным вследствие уменьшения ТАГ в составе ядра. С другой стороны, по ходу того, как истощаются ТАГ, ЛПОНП получают ЭХ от ЛПВП. Образование ЭХ на ЛПВП является важнейшим компонентом системы разгрузки клеток от избытка холестерола. Этот процесс происходит с помощью фермента лецитин-холестеролацилтрансферазы (ЛХАТ). Перенос ЭХ осуществляется специальным белком, переносящим липиды (ЛПБ[4]). ЛПБ также известен как белок, переносящий ЭХ (ЭХПБ) или апо D. ЛХАТ и ЛПБ являются основными участниками процесса “обратного транспорта холестерола”. Он получил такое название, поскольку благодаря ему свободный холестерол из тканей переносится в печень и далее экскретируется из организма. ЛПВП участвуют в этом процессе, но не только они. Часть его (ХС) ЛПВП передают ЛПОНП по мере того, как в составе последних уменьшается количество ТАГ. Образование ЭХ, гидрофобного соединения, позволяет липопротеинам переносить значительно больше холестерина, чем если бы он оставался в свободной (неэстерифицированной) форме. Сложноэфирная связь в ЭХ образуется за счет присоединения ацильной группы, отщепляемой от b-углеродного атома остатка глицерола в составе лецитина, к гидроксильной группе у 3-го “С” холестерина. Именно этот процесс катализирует ЛХАТ. Перенос образовавшихся ЭХ между частицами липопротеинов осуществляет ЛПБ.
Таким образом, общая динамика катаболизма ЛПОНП заключается в потере ТАГ и приобретении ЭХ. Метаболизм ЛПОНП тесно связан с обменом ЛПВП и липопротеинлипазой.
Липопротеины промежуточной плотности (ЛППП). Из ЛПОНП в ходе описанных выше превращений образуются ЛППП. ЛППП не могут эффективно связываться с ЛПЛ, соответственно обмен ЛППП происходит с помощью другого липолитического фермента, печеночной липазы (ПЛ)[5]. Этот фермент синтезируется в гепатоцитах. В синтезе его также принимает участие синусоидальный эндотелий. ПЛ более эффективно, чем ЛПЛ, катализирует гидролиз ФЛ.
О регуляции печеночной липазы известно немного. Увеличение её активности происходит под влиянием тестостерона, других андрогенов и при беременности. Примечательно, что в обоих случаях для ЛПБ являются основными участниками процесса “обратного транспорта холестерола”. Он получил такое название, поскольку благодаря ему свободный холестерол из тканей переносится в печень и далее экскретируется из организма. ЛПВП участвуют в этом процессе, но не только они. Часть его ЛПВП передают ЛПОНП по мере того, как в составе последних уменьшается количество ТАГ. Образование ЭХ, гидрофобного соединения, позволяет липопротеинам переносить значительно больше холестерина, чем если бы он оставался в свободной (неэстерифицированной) форме. Сложноэфирная связь в ЭХ образуется за счет присоединения ацильной группы, отщепляемой от b-углеродного атома остатка глицерола в составе лецитина, к гидроксильной группе у 3-го “С” холестерина. Именно этот процесс катализирует ЛХАТ. Перенос образовавшихся ЭХ между частицами липопротеинов осуществляет ЛПБ.
Таким образом, общая динамика катаболизма ЛПОНП заключается в потере ТАГ и приобретении ЭХ. Метаболизм ЛПОНП тесно связан с обменом ЛПВП и липопротеинлипазой.
Липопротеины промежуточной плотности (ЛППП). Из ЛПОНП в ходе описанных выше превращений образуются ЛППП. ЛППП не могут эффективно связываться с ЛПЛ, соответственно обмен ЛППП происходит с помощью другого липолитического фермента, печеночной липазы (ПЛ)[6]. Этот фермент синтезируется в гепатоцитах. В синтезе его также принимает участие синусоидальный эндотелий. ПЛ более эффективно, чем ЛПЛ, катализирует гидролиз ФЛ.
Вопрос 3. Связанная с рецептором частица ЛПНП подвергается поглощению клеткой Внутри образовавшихся эндосом липопротеины отщепляются от рецепторов. В дальнейшем ЛПНП поступают в лизосомы, где они разрушаются. В лизосомах происходит гидролиз эфиров холестерола, находившихся в составе ЛПНП. В результате образуется свободный холестерол или окисленные его формы. Свободный холестерол используется для различных целей. Он служит структурным компонентом клеточных мембран, субстратом для синтеза стероидных гормонов и желчных кислот. Продукты же его окислительного превращения оказывают регуляторное воздействие на организм.

. Схема поступления в клетки ЛПНП
Контролирующие механизмы координируют использование внутри- и внеклеточных источников холестерола. При достаточном количестве ЛПНП клетки млекопитающих, с помощью рецепторов, преимущественно используют их в качестве источника холестерола. В это время внутриклеточная система синтеза холестерола находится как бы в резерве, не функционирует в полную силу. Дело в том, что внутриклеточное высвобождение из ЛПНП СХ или окисленных его форм, происходящее таким путем, воздействует на ряд процессов по принципу обратной связи и защищают клетку от чрезмерного накопления ХС. Во-первых, уменьшается активность 3-гидрокси-3-метилглютарил-КоА (ГОМГ-КоА) синтетазы и ГОМГ-КоА редуктазы, двух ключевых ферментов внутриклеточного биосинтеза ХС (см. раздел "Биосинтез ХС"). Во-вторых, стеролы активируют фермент ацил-КоА-холестерол ацил трансферазу, который катализирует этерификацию ХС. Это позволяет клеткам депонировать избыток ХС в форме своеобразных внутриклеточных капель, содержащих гидрофобные ЭХ. В-третьих, уменьшается синтез новых рецепторов к ЛПНП[7], что снижает поступление в клетку Обратный
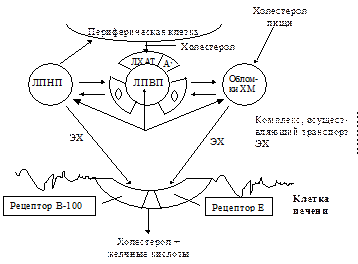
Основные пути транспорта ХС в организме
Происхождение свободного и эстерифицированного ХС в плазме крови
| Липопротеин | Свободный холестерол | Эфиры холестерола |
| ХМ | Синтез в слизистой кишечника | Свободный холестерол |
| ЛПОНП | Гепатоциты | АХАТ гепатоцитов |
| ЛПНП | Гепатоциты | АХАТ гепатоцитов - 60% ЛХАТ плазмы - 40% |
| ЛПВП | Периферические клеточные мембраны - 70% ЛПОНП, ЛПНП - 30% | ЛХАТ плазмы - 100% |
Эфиры холестерина являются гидрофобными соединениями (в отличие от свободного холестерола, у которого имеется гидроксильная группа, сообщающая ему гидрофильность). В силу своей гидрофобности эфиры холестерола теряют способность к диффузии и не могут вернуться обратно в клетку. Они формируют гидрофобное ядро внутри частиц, благодаря которому ЛПВП приобретают сферическую форму. Здесь, в кровотоке из таких ЛПВП осуществляется транспорт вновь образованных неполярных ЭХ из ЛПВП на ХМ, ЛПОНП, ЛППП, который ускоряется за счет белков-переносчиков (см. выше). Затем происходит опосредованное рецепторами поступление ЛПВП, как и других богатых ЭХ липопротеинов, в гепатоциты с последующим их катаболизмом. В частности, высвобождающиеся эфиры холестерола служат исходным субстратом для образования желчных кислот. Аккумуляция холестерола в сосудистой стенке происходит вследствие дисбаланса между поступлением его в интиму сосудов и его выходом. В результате такого дисбаланса холестерол там накапливается. В центрах накопления холестерола формируются структуры - атеромы. Наиболее известны два фактора, которые вызывают дисбаланс в обмене холестерола. Во-первых, это изменения частиц ЛПНП (гликозилирование, перекисное окисление липидов, гидролиз фосфолипидов, окисление апо В). Поэтому они захватываются специальными клетками - "мусорщиками" (главным образом, макрофагами). Захват липопротеиновых частиц с помощью "мусорных" рецепторов протекает бесконтрольно. В отличие от апо В/Е - опосредованного эндоцитоза это не вызывает регуляторных эффектов, направленных на снижение поступления в клетку ХС, описанных выше. В результате макрофаги переполняются липидами, теряют функцию поглощения отходов и превращаются в пенистые клетки. Последние задерживаются в стенке кровеносных сосудов и начинают секретировать факторы роста, ускоряющие клеточное деление. Возникает атеросклеротическая пролиферация клеток.
Организационно- методические указания лаборантскому составу:
Подготовить мультимедийную презентацию лекции в Power Point и flash проекциях
Лекция подготовлена доц. каф. Свергун В.Т.
Дата
Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра биологической химии
Липиды 3. Липолиз. Тканевой обмен липидов
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № 10
Учебные цели:
1.Сформировать представление о липолизе, и путях окислении жирных кислот
2. Регуляция метаболизма липидов.Кетоновые тела, кетоз. Метаболизм холестерина
ЛИТЕРАТУРА
1.Биохимия человека:, Р.Марри, Д.Греннер, П.Мейес, В.Родуэлл.- М.книга,2004.- т.1 -с.274-297..
2.Основы биохимии:А.Уайт, Ф.Хендлер,Э.Смит, Р.Хилл, И.Леман.-М. книга,
1981,т. 2,.с.739-778.
3.Наглядная биохимия: Кольман., Рем К.-Г-М.книга 2004г.-с. 164,3..,304,328,398.
4.Липиды, липопротеиды и атеросклероз: А.Н.Климов, Н.Г.Никульчева,,книга,
Питер,1995г.
5. Harper , s Biochemistry., 1996. by Appleton & Lange,-24- ed..,-p..224-244., 271.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1.Мультимедийная презентация
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
| №п/п | Перечень учебных вопросов | Количество выделяемого Времени в минутах |
| 1. | Липолиз, механизм мобилизации жира | 40 мин |
| 2. | Окисление жирных кислот | 25 мин |
| 3. | Кетоновые тела, биосинтез холестерина | 25 мин |
Всего 90 минут
Введение:Мобилизация, распределение и окисление жирных кислот (Липолиз) происходят с разными скоростями, которых достаточно для обеспечения субстратами до 50% окислительного метаболизма организма. Это происходит при голодании, воздействии холода, физической активности, воспроизведении и росте.
Вопрос 1. Механизм мобилизации жира (роль гормонов, цАМФ и ионов Са+).
Содержащиеся в организме человека массой 70 кг триацилглицеролы (ТАГ) могут дать 100.000 ккал энергии: белки – 60.000 ккал; гликоген – 6.000 ккал; глюкоза - 400 ккал. ТГ составляют 90% среди всех липидов, содержащихся в организме. Наиболее часто встречающимися жирными кислотами в их составе являются олеиновая (18:1), пальмитиновая (16:0) и линолевая (18:2) кислоты. На их долю приходится 75% всех жирных кислот. В норме более 95% ТГ находится в жировой ткани. Оставшиеся 5% локализованы преимущественно в печени и мышцах. При голодании, тяжелом СД, некоторых других состояниях, при которых жир мобилизуется из жировой ткани(ЛИПОЛИЗ) для энергетических целей, количество ТГ в печени увеличивается.
Жировая ткань функционально специализируется на хранении (запасании) и мобилизации ТАГ. При этом за 2-3 недели в адипоците происходит полное их обновление. Схематически процессы синтеза - гидролиза ТАГ изображены ниже.
Предшественниками для синтеза ТАГ являются глицерол-3-фосфат и активированные жирные кислоты. В печени глицерол-3-фосфат может образовываться или в результате фосфорилирования глицерина, или из глюкозы как промежуточный продукт гликолиза. В жировой ткани отсутствует фермент глицеролкиназа; поэтому единственным источником образования глицерол-3-фосфата является гликолиз.Жировая ткань функционально специализируется на хранении (запасании) и мобилизации ТАГ.
Предшественниками для синтеза ТАГ являются глицерол-3-фосфат и активированные жирные кислоты. В печени глицерол-3-фосфат может образовываться или в результате фосфорилирования глицерина, или из глюкозы как промежуточный продукт гликолиза. В жировой ткани отсутствует фермент глицеролкиназа; поэтому единственным источником образования глицерол-3-фосфата является гликолиз.
Жировая ткань функционально специализируется на хранении (запасании) и мобилизации ТАГ. При этом за 2-3 недели в адипоците происходит полное их обновление. Схематически процессы синтеза - гидролиза ТАГ изображены ниже.
Фосфорилирование активирует гормон-чувствительную липазу, тем самым ускоряется гидролиз ТАГ. Адреналин, норадреналин, глюкагон и АКТГ так же активируют этот фермент, в то время как инсулин вызывает его дефосфорилирование, снижая активность
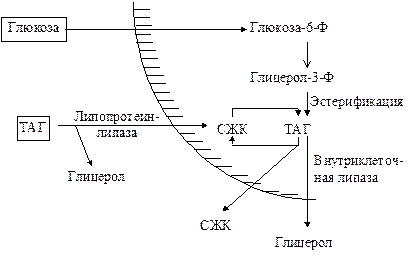
Депонирование жира в жировой ткани сопряжено с питанием и гормональным статусом, которые направлены на стимуляцию поглощения глюкозы. Активация жирных кислот происходит путем их превращения в ацил~КоА под влиянием фермента - ацил~КоАсинтетазы.
Гидролиз триацилглицеролов опосредован липазными ферментами. Активность липазы в клетках жировой ткани находится под строгим регуляторным контролем (отсюда название - гормон-чувствительная липаза). Фермент проявляет субстратную специфичность к ТАГ, 1,2-диацилглицеролам, 2-моноацилглицеролам и эфирам холестерола. Активность гормон-чувствительной липазы регулируется путем фосфорилирования-дефосфорилирования, которые опосредует фермент цАМФ-зависимая протеинкиназа. В результате полного гидролиза молекулы ТАГ образуется 3 молекулы жирных кислот и 1 молекула глицерола. Глицерол из жировой ткани попадает в печень и используется там как предшественник в синтезе глюкозы путем глюконеогенеза. Жирные кислоты выходят из адипоцитов в плазму крови. Они используются любыми тканями, клетки которых содержат митохондрии, способные окислять жирные кислоты с выделением энергии. Однако преимущественно эти жирные кислоты утилизируются в клетках сердечной, скелетных мышц и печени. Другим важным источником ТГ являются ЛП плазмы крови.
Метаболизм ТАГ в жировой ткани скоординирован с анаболической и катаболической фазами метаболизма на уровне целого организма. Вслед за перевариванием пищи в плазме крови увеличивается концентрация глюкозы, инсулина, липопротеинов, богатых ТАГ. Наряду с этим стимулируется образование ТАГ в жировой ткани. В развитие этой анаболической фазы вовлечены переносчики глюкозы и гликолиз; стимулируется активность ЛПЛ для гидролиза ТАГ в составе липопротеинов и снижается активность жиромобилизующей липазы в жировой ткани. Натощак или при повышенной потребности в энергии во время физической работы, повышении уровня катехоламинов, гормона роста, АКТГ и глюкагона в плазме крови, снижении секреции инсулина эти процессы меняются на противоположные - увеличивается липолиз, высвобождаются жирные кислоты, используемые в качестве источника энергии, и глицерол - для глюконеогенеза

Олеиновая кислота (18:1 w 9) или цис - 9 - октадеценовая кислота.
Линолевая кислота (18:2 w 6) или цис -9-цис-12 -октадекадиеновая кислота.
Линоленовая кислота (18:3 w 3) или цис-9, цис-12, цис-15-октадека-триеновая кислота.
Арахидоновая кислота (20:4 w 6) или (эйкозатетраен-5,8,11,14-овая кислота), цис-5, цис-8, цис-11, цис-14- эйкозатетраеновая кислота.
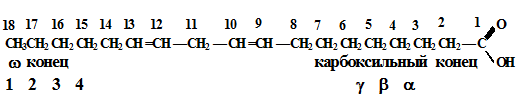
Характерно, что все двойные связи в составе жирных кислот организма имеют цис-конфигурацию Двумя преобладающими мононенасыщенными жирными кислотами животных липидов являются олеиновая и пальмитолеиновая. Олеиновая кислота наиболее широко распространена в природе и преобладает в количественном отношении. Среди полиненасыщенных жирных кислот в тканях млекопитающих наиболее часто встречается линолевая кислота, содержащая две двойные связи, линоленовая - с тремя двойными связями и арахидоновая - с четырьмя двойными связями. Ненасыщенность жирных кислот существенно влияет на их свойства. С увеличением числа двойных связей снижается температура плавления жирных кислот, возрастает их растворимость в неполярных растворителях. Все ненасыщенные жирные кислоты, встречающиеся в природе, при комнатной температуре являются жидкостями. Олеиновая кислота (18:1 w 9) или цис - 9 - октадеценовая кислота.
Линолевая кислота (18:2 w 6) или цис -9-цис-12 -октадекадиеновая кислота.
Линоленовая кислота (18:3 w 3) или цис-9, цис-12, цис-15-октадека-триеновая кислота.
Арахидоновая кислота (20:4 w 6) или (эйкозатетраен-5,8,11,14-овая кислота), цис-5, цис-8, цис-11, цис-14- эйкозатетраеновая кислота.
Транспорт свободных жирных кислот (СЖК) в плазме крови
Как уже упоминалось, основными потребителями СЖК являются клетки сердечной и скелетной мышц, печени. Для этих тканей характерно поглощение 30%-40% СЖК, содержащихся в артериальной крови. Основными СЖК плазмы крови являются пальмитиновая и олеиновая.
Комплекс СЖК - альбумин. Вследствие сильной гидрофобности >99% жирных кислот плазмы циркулируют в нековалетно связанном с альбумином состоянии. Важнейшей функцией альбумина, наиболее распространенного белка во внеклеточной жидкости, является связывание небольших, плохо растворимых в воде молекул. На молекуле альбумина имеется 3 центра связывания, к которым присоединяется 10 и более молекул жирных кислот. В плазме имеется небольшая концентрация жирных кислот, которые не связаны с альбумином, но уравновешены с комплексом альбумин-жирные кислоты. Они могут диффундировать через эндотелий капилляров и поглощаться тканями. Присутствие альбумина обеспечивает существование мощного резервуара жирных кислот в непосредственной близости к тканям всего организма.
Вклад СЖК плазмы крови в энергетический обмен. Период полужизни СЖК плазмы короток (около 1,5 мин), а оборот СЖК плазмы значительный и составляет около 200г/сутки. Если бы все они подверглись окислению, то выделилось бы 1800 ккал энергии. На самом деле, значительная часть этих жирных кислот используется для эстерификации ТАГ.
Оценка вклада СЖК плазмы крови в энергетический обмен
человека
| Параметр | Значение |
| Масса | 70 кг |
| Объем плазмы | 3 л |
| СЖК плазмы (средн. концентрация) | 0,5 ммоль |
| Молекулярная масса СЖК (средн.) | |
| Период полужизни СЖК плазмы | 1,5 мин |
| Оборот СЖК плазмы | 10 ммоль/л 720 ммоль/сутки 201,6 г/сутки |
| Калорический коэффициент оборота (9 ккал/г) | 1818 ккал/сутки |
| Калорическая потребность (умеренная активность) | 2350 ккал/сут |
| Максимальный вклад оборота СЖК плазмы в калорическую потребность | 77% |
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1748; Нарушение авторских прав?; Мы поможем в написании вашей работы!