
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса
|
|
|
|
Изменение энтропии в химическом процессе.
При химической реакции одновременно происходит перенос энергии в системе и изменение в упорядоченности, т.е. расположении частиц относительно друг друга в системе. Мерой беспорядка в системе является величина - энтропия(S).
Пример: 2Н2О → 2Н2 + О2 (электролиз), т.к. количество частиц в системе увеличивается, то ∆ S>0;
2Н2 + О2 → 2Н2О (взрыв), т.к. количество частиц в системе уменьшается, то ∆ S<0.
Энтропия определяется уравнением:
S = k lnW,
где k – универсальная постоянная Больцмана = 1,38*1023 Дж/моль;
W – число способов, по которым можно распределить все молекулы в системе по доступным им энергетическим уровням (вероятность состояния).
Если в системе не изменяется тепловой эффект реакции, то системе характеризуется энтропийным фактором. В таком случае химическая реакция протекает самопроизвольно в сторону увеличения энтропии (→∆ S>0). Изменение энтропии в реакции подчиняется закону Гесса. Это значит, что энтропию можно складывать и вычитать, учитывая коэффициенты в уравнении реакции:
∆S = ∑∆S прод - ∑∆S исх.в
Энтропия веществ, измеренная при стандартных условиях (1 атм, 25°С), называется стандартной энтропией S° (табличное значение).
Величина энтропии зависит от агрегатного состояния веществ.
Пример:Н2О(Г) 45,1 ккал/моль*К
Н2О(Ж) 16,0 ккал/моль*К
Н2О(Т) 10,5 ккал/моль*К
Пример: расссчитать изменение энтропии образования ВаСО3.
ВаО(Т) + СО2(Г) → ВаСО3(Т)
(ВаО(Т)) = 16,8 ккал
S0(СО2(Г)) = 51,1 ккал
S0(ВаСО3(Т)) = 26,8 ккал
∆S0 = НВаСО3 - (НВаО + НСО2) = 26,8 – (16,8 + 51,1) = -41,1 ккал/моль*К
∆S0<0
Таким образом расчеты изменения энтропии реакции показали, что данная реакция самопроизвольно с позиции энтропийного фактора не протекает. Для большинства химических реакций характерно изменение в системе энтальпийного и энтропийного факторов.
Если одновременно происходит изменение и энтальпийного (протекает энергия изменения) и энтропийного (изменение порядка) факторов, то самопроизвольно процесс будет проходить в том направлении, в котором общая суммарная движущая сила реакции будет уменьшаться.. При постоянном давлении общая движущая сила химических процессов называется энергией Гиббса(Gp) (1 атм, 298 К, Gp0 – энергия Гиббса образования) (табличное значение):
∆Gp = G прод - G исх.в
Общая формула расчета: ∆Gp = ∆Н0 - ∆S0*Т или
∆Gp = ∆Н0 – (S0*Т2 - S0*Т1)
Необходимо учитывать, что энтропийный фактор увеличивается с увеличением температуры.
Из формулы следует, что энергия Гиббса позволяет учитывать одновременно изменение энергетического запаса системы и степени беспорядка данной системы. Все самопроизвольные реакции характеризуются отрицательным значением изменения энергии Гиббса. Если ∆Gp >0, о процесс протекает в прямом направлении, если ∆Gp <0, то в системе протекает обратный процесс, если ∆Gp = 0, то система находится в состоянии равновесия.
Закономерность протекания самопроизвольного процесса с «-» значением энергии Гиббса является вторым законом термодинамики, который гласит: теплота не может самопроизвольно переходить от холодного тела к более теплому.
Энергия Гиббса зависит от температуры, концентрации реагирующих веществ (для газов – от давления).
Пример: рассчитать ∆Gp для реакции полимеризации NO2.
2NO2 ↔ N2O4
бурый газ бесцветный газ
Т = 298 К ∆Н f 0 S0
Т1 = 0°С NO 8091 57,46
Т2 = 100°С N2O4 2309 72,73
∆Н0 = 2309-2*8091 = -13873 ккал
∆S0 = 72,73 – 2*57,46 = -49,19 ккал *К
∆Gp = -13873-(-42,19)*298 = -1300 ккал/моль
При 25°С протекает реакция полимеризации NO2 и бурый наз переходит в бесцветный.
∆Gp = -13873-(-42,19)*273 = -23,55 ккал/моль
При 0°С ∆Gp <0, поэтому полимеризацию рекомендуется проводить при пониженных температурах.
∆Gp = -13873-(-42,19)*373 = 1864 ккал/моль
При температуре 100°С бесцветный газ разлагается и снова появляются бурые пары.
Вычисленные значения энергии Гиббса можно рассматривать как сродство реакции в записи уравнения слева направо. Под сродством химической реакции понимают способность веществ взаимодействовать друг с другом. Сродство реакции не является абсолютной величиной, оно изменяется в зависимости от условий проведения реакции и исходного состава системы. Однако, приближенно сродство реакции позволяет оценить возможность протекания реакции в прямом или обратном направлении. Все расчеты привели к трем случаям:
1. ∆Gp < -10 ккал/моль, реакции протекают слева направо в сторону образования соединений.
∆Gp
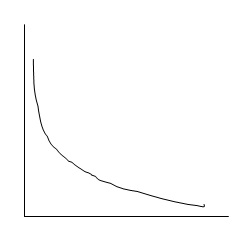
100% 100%
исх.в. прод.р.
2. ∆Gp > -10 ккал/моль, протекает реакция обратная, направлена в сторону распада.:
∆Gp
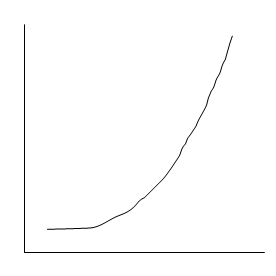
100% 100%
исх.в. прод.р.
3. -10 ккал/моль< ∆Gp < 10 ккал/моль, состояние химического равновесия – реакция идет как в прямом, так и в обратном направлении.
∆Gp
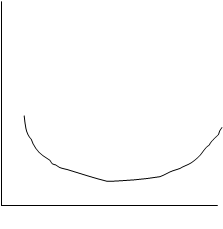
100% 100%
исх.в. прод.р.
Литература:
1. Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
- Т.Браун. Химия – в центре наук / Браун.Т, Лемей Г.Ю. – М.: Мир, 1983. – тт. 1–2.
- Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
- Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
- Кузьменко Н.Е. Краткий курс химии / Н.Е. Кузьменко, В.В Еремин, В.А. Попков. – М.: Высшая школа, 2002. – 415 с.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1249; Нарушение авторских прав?; Мы поможем в написании вашей работы!