
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коллоидные растворы
|
|
|
|
Образование коллоидных растворов может происходить при осаждении и растворении осадков и в ходе некоторых других химико-аналитических процессов. В коллоидных системах растворенное вещество находится в виде частиц размером 10-7...10-5 см, что намного превышает размеры обычных ионов и молекул в истинном растворе, но значительно меньше, чем размеры частиц, выпадающих в осадок. В связи с такими размерами частиц вещество в коллоидном состоянии имеет развитую поверхность, способную адсорбировать большое число ионов, и адсорбированные ионы в значительной степени определяют свойства коллоидных растворов и их особенности.
С химико-аналитической точки зрения важно отметить, что частицы коллоидного раствора проходят через обычные фильтры, применяемые в аналитической химии, и не выпадают в осадок даже при длительном хранении. В проходящем свете коллоидные растворы прозрачны и лишь при боковом освещении можно заметить, что они мутные.
Это явление называют эффектом Тиндаля. Обнаружение эффекта Тиндаля является обычным экспериментальным доказательством существования коллоидного раствора.
Основной причиной устойчивости коллоидных систем является наличие электрического заряда на поверхности коллоидных частиц, который появляется в результате адсорбции ионов. Адсорбция ионов при образовании коллоидной частицы происходит по тем же закономерностям, которые наблюдаются при адсорбции ионов на осадках, т. е. преимущественно адсорбируются ионы, входящие в состав частицы и находящиеся в растворе в избытке. Таким образом, коллоидная частица состоит из ядра, образованного малорастворимым соединением, которое окружено двойным электрическим слоем ионов. Электронейтральная в целом частица называется мицеллой. В химической формуле мицеллы состав ядра обычно заключают в квадратные скобки, а состав ядра вместе с адсорбционным слоем — в фигурные. Например, состав мицеллы хлорида серебра может быть выражен химической формулой:
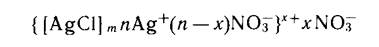
Коллоидные растворы подразделяют на гидрофобные (в неводных растворах лиофобные) и гидрофильные (в неводных растворах лиофильные).
Гидрофобные частицы имеют малое сродство к воде, вязкость их невелика. К их числу относятся коллоиды иодида серебра, сульфида мышьяка (III) и многие другие.
Гидрофильные коллоиды в значительной степени гидратированы, а после высушивания их твердые остатки гигроскопичны. Такими свойствами обладают, например, кремниевая кислота и некоторые другие сильно гидратированные оксиды.
Устойчивость гидрофильных коллоидов выше, чем гидрофобных. Важным свойством гидрофильных коллоидов является их защитное действие на гидрофобные частицы. Введение лиофильных веществ, таких, например, как желатина, повышает устойчивость гидрофобных коллоидов, имеющих такой же заряд.
При введении в коллоидный раствор электролитов происходит сжатие диффузного слоя и даже его разрушение, в результате чего силы отталкивания между частицами уменьшаются, частицы слипаются и выпадают в осадок — происходит коагуляция коллоидного раствора. Чем выше заряд противоиона во введенном электролите, тем при меньшей концентрации наблюдается эффект коагуляции (правило Шульце — Гарди).
Гидрофильные коллоиды коагулируют только при значительных концентрациях электролита. Коагуляции коллоидов способствует также повышение температуры раствора. Таким образом, для разрушения коллоидного раствора и его коагуляции необходимо нагревание и введение электролита.
Промывание водой вызывает удаление коагулирующего электролита, что может восстановить условия устойчивого существования коллоида и перевести осадок в состояние коллоидного раствора. Этот процесс называют пептизацией осадка. Чтобы не допустить пептизации осадка, для промывания обычно применяют не просто воду, а промывную жидкость, содержащую электролит. Очень часто в качестве промывной жидкости используют соли аммония, поскольку они удаляются при прокаливании и не вызывают загрязнения осадка.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3461; Нарушение авторских прав?; Мы поможем в написании вашей работы!