
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенціал індиферентного електрода залежить від співвідношення активностей окисненої та відновленої форм
|
|
|
|
Іонообмінні (мембранні, іоноселективні) електроди в своєму складі мають тверду або рідку мембрану, яка не розчиняється в досліджуваному розчині, і компонент якої здатний оборотньо дисоціювати, надсилаючи в розчин аніон або катіон. Для ІСЕ найважливішою частиною є напівпроникна мембрана, яка відокремлює внутрішню частину електрода (внутрішній розчин)
від аналізованого і має здатність пропускати іони лише одного виду.
Теорію мембранних електродів вперше розробили на основі скляних електродів. За цією теорією мембранний потенціал виникає в результаті встановлення рівноваги іонообмінного процесу між розчином і мембраною. Процес перенесення іона через мембрану складається
із двох стадій:
1) проникнення іона у мембрану;
2) переміщення іона всередині мембрани.
В об’ємі мембрани є певна кількість вільних місць (пустот). Іони проникають у мембрану і займають ці місця. Їхній заряд компенсують фіксовані іони мембрани.
Отже, потенціал на такому електроді виникає внаслідок обміну іонів між розчином і матеріалом мембрани.
KtAn «Ktn+ + Ann-
мембрана розчин
Оскільки мембрана прониклива для одного або обмеженої кількості іонів, то ця властивість забезпечує підвищену селективність ІСЕ. За допомогою ІСЕ можна селективно визначати активності одних іонів у присутності інших. Потенціал ІСЕ лінійно залежить від логарифма активності визначуваних іонів у розчині.
Мембранні електроди влаштовані таким чином, що іонообмінна мембрана розділяє внутрішню камеру електрода від досліджуваного розчину (рис.2).
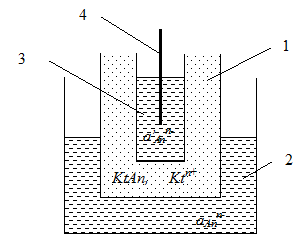
| Рис. 2. Іоноселективний електрод з твердою мембраною. 1 – мембрана, 2 – аналізований розчин, 3 – внутрішній розчин, 4 – внутрішній електрод. |
Якщо у внутрішню камеру вміщено розчин з постійною концентрацією добре розчинної сполуки, що дисоціює на іон, який надсилає в розчин мембрана, внутрішня і зовнішня поверхня електродів набувають зарядів, різниця потенціалів яких дорівнює:

де Δ EM, Eas – різниця потенціалів поверхонь мембрани і потенціал асиметрії,
 – активності аніону в розчині і у внутрішній камері електрода.
– активності аніону в розчині і у внутрішній камері електрода.
Потенціал асиметрії – це невеликий потенціал, який виникає навіть якщо розчини по обидві сторони мембрани ідентичні. Його величина залежить від ряду факторів: неоднорідність мембрани, механічний і хімічний вплив на зовнішню сторону мембрани і ступінь її гідратації. Він повільно змінюється в часі, особливо якщо мембрана висихає. Eas набуває невеликої постійної величини порядка сотих або десятих часток вольта.
У внутрішню камеру електрода занурюють електрод переважно ІІ-го роду. При постійному складі внутрішнього розчину потенціал мембранного електрода залежить від активності іона, на який дисоціює компонент мембрани:
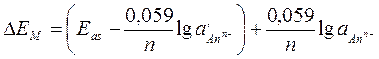
На потенціал мембранних електродів, крім визначуваних іонів, в певних умовах впливає присутність у розчині деяких інших іонів. У цьому випадку справедливе загальне рівняння:
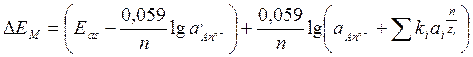
де ki - коефіцієнти селективності електрода, який показує, у скільки разів електрод чутливіший до даного іона, ніж до стороннього;
zi - заряд сторонніх іонів.
Чим менші ці коефіцієнти, тим селективніші електроди. Вони дозволяють оцінити придатність різних іоноселективних електродів для розв'язування конкретних аналітичних завдань.
В твердих іоноселективних електродах іоночутливий елемент виготовляють з малорозчинної кристалічної речовини з іонним характером провідності. Перенос заряда в такому кристалі відбувається за рахунок дефектів кристалічної гратки. Вакансії в гратці можуть займатись іонами тільки певного розміру і заряда.
Із електродів цього типу широко застосовується фторидний електрод, в якому мембраною є монокристал LaF3 з добавкою EuF2 для збільшення електричної провідності. Чутливість фторидного електрода дозволяє проводити вимірювання рівноважної концентрації фторид-іонів F- в діапазоні 10-6 – 1 моль/л. Селективність електрода дуже висока і наявність сторонніх іонів Hal-, NO3-,SO42- та ін. не перешкоджає визначенню F-. Однак в присутності ОН--іонів селективність падає, бо на поверхні електрода може утворюватись осад La(OH)3. Робота фторидного електрода погіршується також в присутності лігандів, які утворюють з іоном La3+ міцні координаційні сполуки в розчині (цитрат-, оксалат-іони та ін.).
Фторидний електрод використовується для визначення іонів F- у воді, різних біологічних пробах, вітамінах, при контролі за забрудненням довкілля.
Скляні іоноселективні електроди, чутливі до іонів Li+, Na+, K+, Rb+, Cs+, Ag+, Tl+, NH4+, застосовуються для визначення цих катіонів в різних об’єктах (кров, плазма, вода, екстракти рослин та ін.).
Визначення за допомогою іоноселективних електродів успішно конкурує з полум’яно-фотометричними методами та нерідко переважає їх за швидкістю і точністю.
Вимоги до електродів:
1. Стабільність і відтворюваність потенціалу.
2. Оборотність електродної реакції.
3. Відсутність поляризації при проходженні невеликого струму.
4. Зручність у роботі.
Таким чином, аналітичним сигналом потенціометричних методів аналізу є потенціал електрода, який залежить від природи визначуваних іонів та їх активності. Оскільки цей аналітичний сигнал є одномірним, він може використовуватися тільки для кількісного аналізу.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!