
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електронегативність
|
|
|
|
Енергія іонізації характеризує здібність атому втрачати електрон, спорідненість до електрону характеризує здібність атому зміщувати у свій бік електрон, при утворені зв’язку ввели таке поняття, як Електронегативність атому.
Електронегативністю наз. півсуму енергію іонізації(І) та споріненісю(F) даного елементу 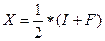 К/моль.
К/моль.
Електронегативність характеризує здатність атому притягувати до себе валентні електрони.
Як будь-які фіз. властивості атому Електронегативність елементів закономірно змінюється із зростанням порядкового номеру, характер закономірності – періодичні.
У періодах для елементів головних підгруп електронег. зростає із збільшенням (s-ел.), порядкового номера т.б. починається період найменшої Електронегативністю, а закінчується (p-ел 7гр) – найбільш електор.
Що стосується p елемент 8гр (гелій, аргон) – то електронег. дуже низька, бо хоч ці елементи мають найвищу енергію іонізації, але ж мають дуже низьку спорідненість до електронів, тому по формулі півсума цих величин дуже мала. Якщо розглядати періодичну систему в цілому то найбільш електронег. елементи знаходяться в правому верхньому кутку (фтор, кисень, азот, сірка, фосфор).
Найменш електронегативні елементи в лівому нижньому кутку.
Металічні елементи мають такі загальні характеристики: низькі значення енергії іон., низькі значення спорідненості до електрону H (еме)- навпаки, висока (І), висока (F), як наслідок висока (X).
Li Be B C N O F
0.98 1.57 2.09 2.55 3.04 3.44 3.98
Дослідження будови атомів показали, що найважливіший і найстійкішою характеристикою атома є позитивний заряд ядра.
Тому сучасне формулювання періодичного закону Д.І. Менделєєва таке:
Властивості хім.. елем. та їх сполук перебувають у періодичні залежності від заряду ядер атомів елементів.
Отже, дослідження будови атомів створили наукову основу періодичного закону.
Запитання для самоконтролю
1. Охарактеризуйте найбільш вдалі спроби класифікації хімічних елементів до відкриття періодичного закону Д.І.Менделєєвим.
2. Сформулюйте періодичний закон. Охарактеризуйте періодичну систему хімічних елементів.
3. Визначити закони квантової механіки.
4. Визначити постулати Бора.
5. Охарактеризуйте квантові числа (головне, орбітальне, магнітне, спінове). Наведіть приклади визначення цих чисел хімічних елементів різних періодів.
6. Визначити правило Гунда.
7. Визначити принцип Паулі.
8. Визначити перше та друге правила Клечковського.
9. Що називається енергією йонізації, спорідненістю атома до електрона, електронегативністю?
10. Охарактеризуйте будову атома, будову ядра атома.
11. Радіоактивність. Радіоактивні ряди.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1066; Нарушение авторских прав?; Мы поможем в написании вашей работы!