
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы решения уравнения диффузии
|
|
|
|
Существует несколько методов решения уравнения (359). Рассмотрим лишь наиболее употребимые
Для решения уравнения диффузии вводится подстановка Больцмана:

| (361) |
Преобразовав выражения для 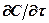 и
и 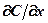 и дифференцируя
и дифференцируя 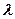 по
по 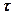 и
и 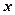 , получим
, получим
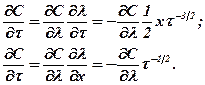
| ((362) |
Выражение (359) приводится к виду

Подставив в это уравнение значения 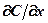 и
и 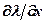 из (362), найдем
из (362), найдем

|
Используя это выражение и уравнение (362), приходим к обыкновенному дифференциальному уравнению
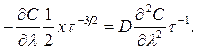
С учетом (361)
 (363)
(363)
Пусть
 (364)
(364)
где А, а, n — некоторые промежуточные константы. Подставив вы-
ражение (364) в (363), получим
 (365)
(365)
Это уравнение выполняется при n=2, а=1/(4D). При этом (364)
принимает вид
 (366)
(366)
Проинтегрировав (366) в пределах от  до
до 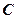 и от О до
и от О до 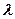 , оп-
, оп-
ределим

 (368)
(368)
где  — исходная концентрация источника диффузии.
— исходная концентрация источника диффузии.
Второе слагаемое в (368) называется функцией ошибок и обозначается через erf. Тогда выражение (368) запишется в виде

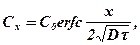 (369)
(369)
где функцию erfc называют дополнительной функцией ошибок.
Значения функций  и
и  табулированы.
табулированы.
Формула (369) позволяет при известном значении коэффициента
диффузии вычислить распределение концентрации диффузанта
вдоль оси х для различных моментов времени (рис. Д.2). Если
диффузант распространяется в направлении х>0, то расчет проводится по правой ветви кривой, если в направлении х<0, то по левой.
Если диффузия протекает в обе стороны, то расчет ведется по всей
кривой.
На рис. Д.3 показано распределение концентрации диффузанта
при диффузии в заданную область (х>0) из источника с постоянной концентрацией  . Соотношение (369) используется для рас-
. Соотношение (369) используется для рас-
чета диффузии заданного компонента в твердое тело, например полупроводник из газовой фазы постоянного состава (бесконечный
источник).
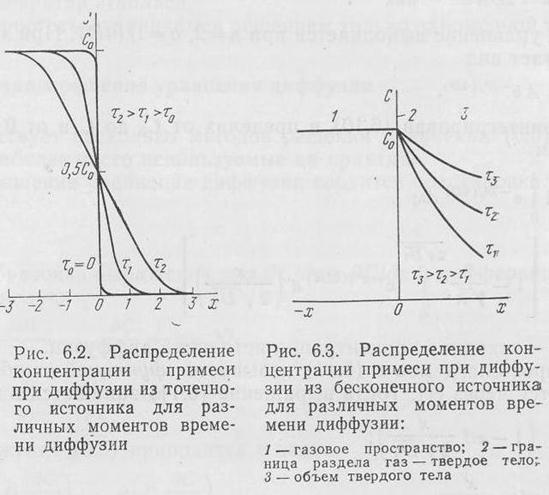
При диффузии из конечного источника его концентрация меняется, что приводит к изменению концентрации на границе раздела
источник — поверхность твердого тела. Процесс диффузии в этом
случае описывается уравнениями, подобными уравнениям распространения теплового импульса, а распределение концентрации диф-
фузанта— функцией Гаусса. Для одно-, двух- и трехмерной диффу-
зии получим
 (370)
(370)
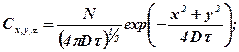 (371)
(371)
 (373)
(373)
где N — количество диффузанта (обычно твердого или жидкого).
Влияние температуры на коэффициент диффузии
Коэффициент диффузии D характеризует физические свойства
веществ, растворяемых друг в друге: основы А и диффузанта В.
Для газов коэффициент диффузии вычисляется по уравнению,
полученному нз кинетической теории газов:
 (374)
(374)
где 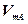 ,
,  — молярные объемы компонентов А и В, МA, MB -
— молярные объемы компонентов А и В, МA, MB -
молярные массы компонентов А и В.
Для жидкостей - к
оэффициент диффузии для разбавленных растворов определяют
по уравнению Стокса — Эйнштейна:
 (375) где
(375) где  — динамическая вязкость раствора;
— динамическая вязкость раствора;  — постоянная Больц-
— постоянная Больц-
мана;  — радиус молекул растворенного вещества.
— радиус молекул растворенного вещества.
Уравнение (375) неудобно для практического использования.
поэтому его приводят к виду
 (376)
(376)
где F — параметр, зависящий от природы диффузанта и раствори-
теля.
При выводе и решении уравнений диффузии (357) и (359) атомная природа процесса не учитывалась. При ее учете необходимо рассмотривать кристаллическую решетку твердого
тела.
Каждый атом решетки совершает непрерывные колебания
около положения равновесия. За счет флуктуаций амплитуды не-
которые колебания могут оказаться настолько большими, что атомы
могут перейти на соседнюю плоскость кристаллической решетки.
Для этого необходимы большие флуктуации энергии и синхронность движения нескольких атомов. Установить
связь диффузии с беспорядочным движением атомов можно проанализи-
ровав две соседние атомные плоскости 1 и 2, находящиеся на рас-
стоянии а друг от друга, с концентрациями диффузанта в плоско-
стях, равными С1 и С2. Положив, что перемещения атомов из плоскости 1
на плоскость 2 и обратно равновероятны, а их частота  одинакова.
одинакова.
Число атомов диффузанта на единице поверхности плоскости 1
 , плоскости 2
, плоскости 2  .
.
За промежуток времени  , малый по сравнению с
, малый по сравнению с  , число
, число
перемещающихся атомов диффузанта из плоскости 1 в плоскость 2
равно  . Число плоскостей
. Число плоскостей  , в которые могут переместиться
, в которые могут переместиться
атомы диффузанта, для разных кристаллических решеток различно.
Для простой кубической решетки  .
.
В этом случае из всех атомов диффузанта, перемещающихся из
плоскости 1 в плоскость 2 за время  , будет переходить только
, будет переходить только
1/6 часть. Результирующее число атомов на единицу поверхности,
переходящих из плоскости 1 в плоскость 2 в единицу времени, определяет поток атомов:
 (377)
(377)
Если ось х перпендикулярно плоскостям 1, 2, то концентрации
С1 и С2 связаны между собой соотношением  . С уче-
. С уче-
том этого уравнение (377) запишеться:
 (378)
(378)
Сравнив (378) с (357), получим
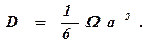 (379)
(379)
Таким образом, коэффициент диффузии определяется частотой
перемещения атомов. Уравнение (379) является общим и не учитывает
механизма процесса. Для некубических и неидеальных решеток час-
тоты перемещения атомов с одной плоскости на другую не равны.
Поэтому коэффициенты диффузии для разных направлений различны.
Технологическими пара-
метрами, которые необходимо учитывать, являются: время диффузии, температура, растворимость примеси, свойства источника диф-
фузанта, состояние поверхности подложки, степень совершенства
кристаллической структуры подложки и др. Точность, с которой эти
параметры поддерживают в ТП, во многом определяет стабильность
качества диффузионных структур твердого тела
и соответствующих элементов ЭС.
Значение а в уравнении (379) зависит от вида кристаллической
решетки; оно незначительно меняется при изменении температуры.
Следовательно, существенная зависимость коэффициента диффузии
D от температуры Т, а также вида растворители и диффузанта оп-
ределяется частотой  . Значение
. Значение  можно найти с
можно найти с
помощью расчета.

Рассмотрим атом внедрения в простой кубической решетке
(рис. Д.6, а). Атом совершает колебания во всех направлениях.
Его средняя частота колебаний в направлении х равна  . Атомы
. Атомы
растворителя колеблются около своих положений равновесия. Большинство колебаний внедренного атома не приводит к изменению
его положения, однако отдельные, очень сильные колебания или не
которые случайные совпадения направлений колебаний внедренного атома и атомов растворителя могут привести к перемещению его
в соседнее положение. Расположение атомов в промежуточный
момент времени (в седловидной точке) показано на рис. Д.6, б. Для
вычисления  определяют ту частоту колебаний
определяют ту частоту колебаний  в данном на-
в данном на-
правлении, которая приведет к перемещению атомов диффузанта:
 (380)
(380)
где  — изменение свободной энергии при перемещении атома.
— изменение свободной энергии при перемещении атома.
3начение свободной энергии в зависимости от положения атома
внедрения представлено на рис. Д.6, в.
Число колебаний, приводящих к перемещению атомов в данном
направлении, определяется отношением энергии  , к средней ки-
, к средней ки-
нетической энергии  атомов в кристаллической решетке. При
атомов в кристаллической решетке. При
повышении температуры средняя кинетическая энергия атомов воз-
растает. В результате отношение  уменьшается и часто-
уменьшается и часто-
та  растет.
растет.
Расположение атомов, показанное на рис. Д.6, б, возможно лишь
в течение короткого промежутка времени. Тем не менее. принято
считать, что уравнение (380) справедливо. Тогда
 (381)
(381)
Подставив значенне  в уравнение (379) и учтя, что
в уравнение (379) и учтя, что  , получим
, получим
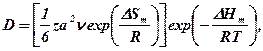 (382)
(382)
где  — энтальпия;
— энтальпия; 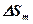 — энтропия процесса.
— энтропия процесса.
Если уравнение (382) сравнить с эмпирическим
 (383)
(383)
то нетрудно видеть, что коэффициент  эквивалентен выражению,
эквивалентен выражению,
заключенному в квадратные скобки в уравнении (382). При этом 
— энергия, необходимая для перемещения атома из равновесного положения в промежуточное и называемая энергией ак-
тивации диффузии данной примеси.
Зависимость коэффициента диффузии от температуры в коорди-
натах  прямолинейна.
прямолинейна.
Сильное влияние температуры на диффузионное распределение
вынуждает очень тщательно регулировать температуру при полу-
чении диффузионных слоев в производстве ЭС.
Влияние концентрации примесей на коэффициент диффузии
Зависимость коэффициента диффузии от концентрации диффу-
занта усложняет формулировку законов диффузии. Второй закон
Фика запишется в виде
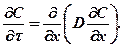 (384)
(384)
Это более общая и в данном случае более удобная форма записи
второго закона Фика по сравнению с обычно используемой (359).
Подставив (361) в выражение (384), получим
(361) в выражение (384), получим
 (385)
(385)
При граничном условии  для области х <0 С =1, а для об-
для области х <0 С =1, а для об-
ласти х >0 С =0, производная 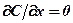 при
при 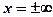 . Решая (385),
. Решая (385),
найдем
 (386)
(386)
После подстановки (в 386)  коэффициент
коэффициент
 (387)
(387)
Приняв время диффузии постоянным 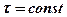 и учитывая, что
и учитывая, что 
получим
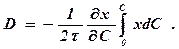 (388)
(388)
Следовательно, для определения зависимости D от концентра - ции С необходимо найти значения 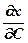 и
и 
Если коэффициент диффузии не
за
висит от концентрации, то диффузионная
граница на рис. Д.8 проходит через х =0 и граничная концентрация равна  При
При
— наличии зависимости D от концентрации С характер кривой С(х) изменяется и диффу-
зионная граница смещается в положение 01.
Решение уравнения (388) осуществляют графическим способом по зависимости D от концентрации компонента.
т. е. для нахождения D в заданной точке А, необхо-димо
определить площадь заштрихованной
(рис. Д.8) фигуры, ограниченной диффузионной кривой в интервале концентраций от
0 до СА, линией, соответствующей оконча-
тельной границе раздела, и осью х. Значе-
ние дх/дС графически можно найти, проведя к точке А касатель-
ную. Котангенс угла наклона этой прямой к оси абсцисс и являет-
ся искомой величиной. Подставив значения дх/дС и  в (388),
в (388),
получим значение D для данной точки.

Для двухкомпонентной системы коэффициент диффузии D свя-
зан с парциальными коэффициентами диффузии D1 и D2 соотноше-
нием


где С1, С2 — атомные концентрации компонентов 1 и 2.
 |
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1252; Нарушение авторских прав?; Мы поможем в написании вашей работы!