
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
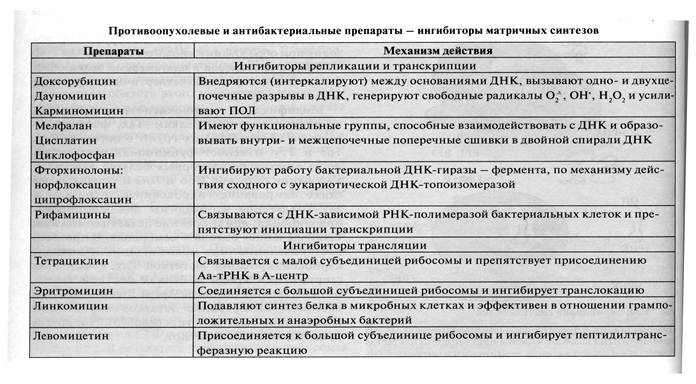
Ингибиторы матричных биосинтезов
|
|
|
|
Посттрансляционные модификации белков
Полипептиды, являющиеся продуктом трансляции, не всегда функционально активны и требуют дополнительных посттрансляционных преобразований.
Фолдинг молекул. Так, еще в процессе синтеза полипептидных цепей на рибосоме при участии шаперонов происходит образование вторичной третичной структуры белков и формирование более выгодной пространственной конформации.
Образование дисульфидных связей – между остатками цистепина имеет важное значение для формирования нативной структуры белков (инсулина, иммуноглобулинов и рибонуклеазы).
Частичный протеолиз сопровождает синтез всех белков на экспорт, равно как и некоторых внутриклеточных белков, в результате молекулы укорачиваются и меняют конформацию.
Присоединение простетической группы происходит при образовании сложных белков
Сборка протомеров в олигомерные белки обеспечивает формирование четвертичной структуры
Модификация аминокислотных остатков свойственна многим белкам.
1. Фосфорилирование гидроксильных групп в остатках серина, треонина и тирозина изменяет функциональную активность многих регуляторных белков.
2. Гидроксилирование остатков пролина и лизина в молекуле коллагена необходимо для формирования фибрилл.
3. Карбоксилирование глутамина в факторах свертывания крови и белках костной ткани.
4. Метилирование аргигина и лизина в молекулах гистонов
5. Йодирование тирозина в белке щитовидной железы.
Остановка любого из матричных синтезов опасна для клеток и может вызвать их гибель. В настоящее время описана довольно большая группа разных по структуре соединений, которые являются ингибиторами этих процессов.
Интерфероны – небольшие белки – гликопротеины, которые секретируются клетками макрофагов, В и Т-лимфоцитов в ответ на вирусную инфекцию. Эти белки, связываясь с рецепторами на плазматической мембране зараженных клеток, индуцируют синтез белков и ферментов, способных разрушать мРНК вирусов и прекращать синтез белков на рибосомах. В результате синтез всех белков в инфицированных клетках прекращается. Клетки погибают, но при этом останавливается размножение вирусов и наступает выздоровление.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 819; Нарушение авторских прав?; Мы поможем в написании вашей работы!