
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм гидролиза по аниону
|
|
|
|
В гидративном анионе 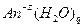 молекулы воды связаны с анионом за счёт водородных связей. Поляризационное взаимодействие между анионом и молекулой воды может привести к превращению водородной связи в ковалентную, при этом протон, отрываясь от молекулы воды, присоединяется к аниону, а в раствор уходит гидроксид-ион.
молекулы воды связаны с анионом за счёт водородных связей. Поляризационное взаимодействие между анионом и молекулой воды может привести к превращению водородной связи в ковалентную, при этом протон, отрываясь от молекулы воды, присоединяется к аниону, а в раствор уходит гидроксид-ион.
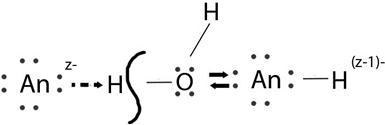
В результате заряд аниона уменьшается на единицу.
Чем больше заряд и меньше радиус аниона, тем более хорошим донором электронных пар он ялвляется, и тем легче происходит отрыв протона от воды. Анионы сильных кислот ( и др.) обладают слабыми электроно-донорными свойствами и гидролизу не подвергаются. Анионы слабых кислот (
и др.) обладают слабыми электроно-донорными свойствами и гидролизу не подвергаются. Анионы слабых кислот ( и др.) являются донорами средней силы и подвергаются гидролизу. Гидролиз многозарядных анионов идёт ступенчато. В результате гидролиза среда становится щелочной (
и др.) являются донорами средней силы и подвергаются гидролизу. Гидролиз многозарядных анионов идёт ступенчато. В результате гидролиза среда становится щелочной ( ).
).
Все известные случаи гидролиза солей можно классифицировать следующим образом:
1. Соли, гидролизующиеся по катиону, - соль образована сильно поляризованным катионом и слабо поляризующим анионом (соль слабого основания и сильной кислоты). Например,  и др. При растворении таких солей реакция среды кислая.
и др. При растворении таких солей реакция среды кислая.
2. Соли, гидролизующиеся по аниону, - соль, образована сильно поляризующим анионом и слабо поляризующим катионом (соль сильного основания и слабой кислоты). Например,  и др. Реакция среды щелочная.
и др. Реакция среды щелочная.
3. Соли, гидролизующиеся и по катиону и по аниону, - соль образована сильно поляризующим и анионом и катионом (соли слабых оснований и кислот). Например,  . Растворы солей этого типа в зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания могут иметь слабокислую или слабощелочную среду, т. Е. величина
. Растворы солей этого типа в зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания могут иметь слабокислую или слабощелочную среду, т. Е. величина  близка к 7.
близка к 7.
Показателем глубины гидролиза является степень гидролиза 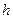 , представляющая собой отношение концентрации гидролизующих молекул
, представляющая собой отношение концентрации гидролизующих молекул  к исходной концентрации растворённых молекул электролита:
к исходной концентрации растворённых молекул электролита:

Степень гидролиза возрастает с разбавлением раствора и увеличением температуры, поскольку гидролиз – процесс эндотермический.
Процесс гидролиза характеризуется константой равновесия. Рассмотрим процесс гидролиза соли, образованной однокислотным сильным основанием и одноосновной слабой кислотой:

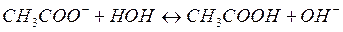
В этом случае константа равновесия

Так как концентрация воды при гидролизе изменяется очень мало, то её принимают за постоянную величину и переносят в левую часть уравнения:

Произведение 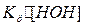 является величиной постоянной и обозначается
является величиной постоянной и обозначается 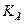 - константа гидролиза. Умножим числитель и знаменатель на равновесную концентрацию водорода и получим:
- константа гидролиза. Умножим числитель и знаменатель на равновесную концентрацию водорода и получим:
Произведение  даёт ионное произведение воды
даёт ионное произведение воды 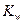 , а отношение
, а отношение

Является обратной величиной константы диссоциации слабой кислоты  . В общем виде уравнение принимает вид:
. В общем виде уравнение принимает вид:

Для расчета степени гидролиза объединим два уравнения:
 и
и 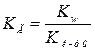

Примем, что концентрация соли равна  (моль/л). Если степень гидролиза равна
(моль/л). Если степень гидролиза равна 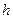 , то подверглось гидролизу
, то подверглось гидролизу  моль/л, не гидролизовано
моль/л, не гидролизовано  соли. Вследствие гидролиза образовалось
соли. Вследствие гидролиза образовалось  моль/л кислоты и
моль/л кислоты и 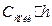 моль/л
моль/л  . Учтя это, получим:
. Учтя это, получим:
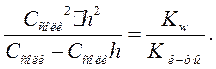
Откуда

Если величина 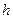 мала в сравнении с 1, то получим:
мала в сравнении с 1, то получим:


Как уже было указано, процесс гидролиза приводит к изменению реакции среды. Для вывода формулы расчёта  раствора соли, образованной катионом сильного основания и анионом слабой кислоты, воспользуемся уравнением:
раствора соли, образованной катионом сильного основания и анионом слабой кислоты, воспользуемся уравнением:

При гидролизе соли, содержащей однозарядные катион и анион,  , тогда
, тогда

Если степень гидролиза мала ( ), то концентрация негидролизованной части соли
), то концентрация негидролизованной части соли  приблизительно равна
приблизительно равна  (соль, как сильный электролит, практически полностью диссоциирована в растворе). С учётом этого уравнение принимает вид:
(соль, как сильный электролит, практически полностью диссоциирована в растворе). С учётом этого уравнение принимает вид:

Переходя от  к
к  (
(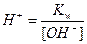 ), получим
), получим

Обозначим 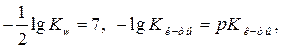 , получим формулу для расчёта
, получим формулу для расчёта 
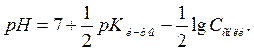
Следует учитывать, что если степень гидролиза больше 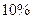 , то вычисление
, то вычисление  следует проводить по более точному уравнению, принимая во внимание, что концентрация негидролизованной части соли
следует проводить по более точному уравнению, принимая во внимание, что концентрация негидролизованной части соли  не равна
не равна  .
.
При гидролизе соли, образованной одноосновной сильной кислотой и однокислотным слабым основанием, константа равновесия равна:

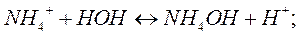

Данную формулу можно преобразовать подобно предыдущему случаю:

Умножим числитель и знаменатель на равновесную концентрацию гидроксила и получим:

Произведение  даёт ионное произведение воды
даёт ионное произведение воды 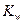 , а отношение
, а отношение
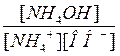
является обратной величиной константы диссоциации слабого основания  . В общем виде уравнение принимает вид:
. В общем виде уравнение принимает вид: 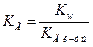
Выведем формулу для расчёта степени гидролиза
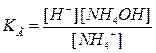 и
и 
Допустим, что соль слабо гидролизуется (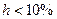 ) и обозначим концентрацию подвергшейся диссоциации соли как и в предыдущем случае, тогда
) и обозначим концентрацию подвергшейся диссоциации соли как и в предыдущем случае, тогда
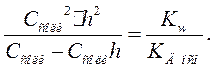
Откуда

Если величина 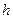 мала в сравнении с 1, то получим:
мала в сравнении с 1, то получим:


Вывод формулы для расчёта  также аналогичен предыдущему с учётом, что
также аналогичен предыдущему с учётом, что  :
:


Перейдём от концентрации ионов водорода к  :
:
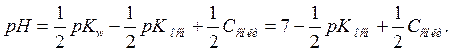
Константа гидролиза соли, образованной слабым основанием и слабой кислотой, определяется константой диссоциации как кислоты, так и основания:



Отношения  и
и  согласно константам диссоциации кислоты и основания равны:
согласно константам диссоциации кислоты и основания равны:

Следовательно:
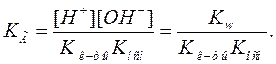
Степень гидролиза при этом не зависит от исходной концентрации соли. Для подтверждения этого обозначим по-прежнему общую концентрацию соли через  , а степень гидролиза через
, а степень гидролиза через 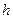 . Тогда число подвергшихся гидролизу молей соли равно
. Тогда число подвергшихся гидролизу молей соли равно 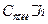 . Из каждой молекулы этой соли при гидролизе образуется одна молекула кислоты и одна молекула основания. Тогда:
. Из каждой молекулы этой соли при гидролизе образуется одна молекула кислоты и одна молекула основания. Тогда:
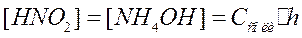
Концентрация соли, не подвергшейся гидролизу, равна:

Считая её практически полностью диссоциированной, в первом приближении имеем:

Воспользуемся этими обозначениями для уравнения:
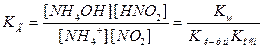
Получим:

откуда

или

В результате гидролиза данной соли  раствора также не зависит от концентрации соли. В этом случае можно снова принять, что практически
раствора также не зависит от концентрации соли. В этом случае можно снова принять, что практически  и
и  . В этом случае получим следующее равенство:
. В этом случае получим следующее равенство:

С другой стороны, так как

то, учитывая данное уравнение, получим:

Решая это уравнение относительно ионов водорода, получим:

Соль, содержащая в составе молекулы многозарядный катион или анион, как указано выше, подвегается ступенчатому гидролизу, например:
1-я ступень: 

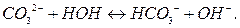
2-я ступень: 

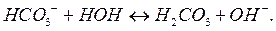
Или
1-я ступень: 
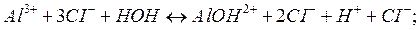

2-я ступень: 


3-я ступень: 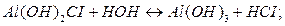


Таким образом, ступенчатый гидролиз приводит к образованию кислых и основных солей, но гидролиз по второй и третьей ступеням идёт в незначительной степени или же только при создании определённых условий.
В некоторых случаях явление гидролиза отрицательно влияет на проведение реакций химической идентификаций, следовательно, необходимо знать способы усиления и подавления гидролиза. Усилить или подавить гидролиз можно тремя способами:
· прибавлением к раствору соли другого электролита, способного подвергаться гидролизу, например кислоты или щёлочи;
· изменением концентрации раствора;
· понижением или повышением температуры раствора.
Для усиления гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты, необходимо добавить основание для связывания получающихся в процессе гидролиза ионов водорода

При добавлении основания произойдёт нейтрализация кислоты, и динамическое равновесие сдвинется вправо, т.е. гидролиз усилится. Если же к раствору подобной соли прибавить кислоты, то гидролиз затормозится.
Чтобы усилить гидролиз соли, образованной анионом слабой кислоты и катионом сильного основания, необходимо связать свободные анионы гидроксила, получающиеся в процессе гидролиза:

Прибавление кислоты приводит к нейтрализации основания, и динамическое равновесие сдвигается вправо, т. е. гидролиз усиливается. Если в раствор подобной соли внести основание, то гидролиз замедлится.
Связать ионы  и
и  можно добавлением не только щелочей или кислот, но и других электролитов. Например, ионы водорода можно связать в сложные анионы (
можно добавлением не только щелочей или кислот, но и других электролитов. Например, ионы водорода можно связать в сложные анионы ( и др.) или в нейтральные молекулы слабых кислот (
и др.) или в нейтральные молекулы слабых кислот (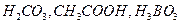 и т. п.), действуя на растворы гидролизующихся солей солями, образованными катионом сильного основания и анионом слабой кислоты, например
и т. п.), действуя на растворы гидролизующихся солей солями, образованными катионом сильного основания и анионом слабой кислоты, например  :
:

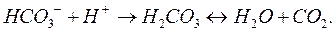
Ионы гидроксила можно связывать в комплексные ионы  и др., или в нейтральные молекулы слабых оснований, действуя на растворы гидролизующихся солей солями, образованными катионом слабого основания и анионом сильной кислоты.
и др., или в нейтральные молекулы слабых оснований, действуя на растворы гидролизующихся солей солями, образованными катионом слабого основания и анионом сильной кислоты.
Подобно гидролизу, наблюдающемуся в водных растворах, соли также подвергаются сольволизу в неводных растворах. Сольволизом в неводных растворах называют взаимодействие монов растворённого вещества с ионами растворителя. Например, в среде безводного этилового спирта  и
и  реагируют согласно уравнениям:
реагируют согласно уравнениям:
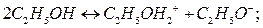

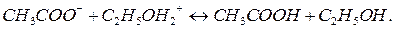
В этом случае также можно рассчитать константы сольволиза. Если сольволиз идёт по аниону, следует использовать следующее уравнение:

где  - ионное произведение (константа автопролиза) данного растворителя;
- ионное произведение (константа автопролиза) данного растворителя;
 - константа диссоциации кислоты в данном растворителе.
- константа диссоциации кислоты в данном растворителе.
Если же сольволиз идёт по катиону, то соответственно

где 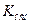 - константа диссоциации основания в данном растворителе.
- константа диссоциации основания в данном растворителе.
Амфотерность гидроксидов
При проведении некоторых частных реакций данной группы вы убедитесь, что некоторые вещества, в зависимости от условий, могут проявлять свойства и кислот, и оснований. Такое явление получило название амфотерности. Это явление объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Следовательно, диссоциация таких молекул возможна по местам обеих связей. Если обозначить амфотерный электролит формулой  , то его диссоциацию можно выразить формулой:
, то его диссоциацию можно выразить формулой:

К числу амфотерных соединений относятся гидроксиды бериллия, алюминия, хрома, цинка и др. Возьмём в качестве примера гидролиз цинка. Основные его свойства проявляются во взаимодействии с кислотами:



Гидроксид цинка также легко растворяется в щелочах с образованием цинкатов:

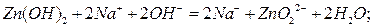
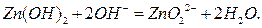
Следовательно, в системе гидроксида цинка осадок-раствор имеется следующий тип равновесия:

Исходя из такого допущения, легко объяснить способность  в кислотах и щелочах. При введении в раствор гидроксид-ионов щёлочи происходит связывание
в кислотах и щелочах. При введении в раствор гидроксид-ионов щёлочи происходит связывание  , образуемого гидроксидом цинка. Вследствие этого раствор становится ненасыщенным относительно
, образуемого гидроксидом цинка. Вследствие этого раствор становится ненасыщенным относительно  , что влечёт за собой растворение осадка и накопление
, что влечёт за собой растворение осадка и накопление  . При действии кислот происходит противоположный процесс: связывание
. При действии кислот происходит противоположный процесс: связывание  и накопление в растворе
и накопление в растворе 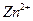 , т. е. соли цинка соответствующей кислоты.
, т. е. соли цинка соответствующей кислоты.
Данная схема не даёт полного объяснения явления амфотерности. В настоящее время амфотерность рассматривается на основе процессов комплексообразования и гидратации молекул гидроксидов и образующихся из них ионов. Например, при растворении  в воде образуются гидративные молекулы состава
в воде образуются гидративные молекулы состава  , так как кислород воды за счёт своих неподелённых пар образует более прочные координационные связи с атомом металла, чем атом хлора. Такой же состав имеют и кристаллогидраты, выделяемые из водных растворов хлорида алюминия. Гидратированные молекулы хлорида алюминия, подвергаясь дальнейшей гидратации, диссоциируют на ионы:
, так как кислород воды за счёт своих неподелённых пар образует более прочные координационные связи с атомом металла, чем атом хлора. Такой же состав имеют и кристаллогидраты, выделяемые из водных растворов хлорида алюминия. Гидратированные молекулы хлорида алюминия, подвергаясь дальнейшей гидратации, диссоциируют на ионы:

Гидратированные ионы  проявляют свойства кислот, так как протоны координационно-связанной воды испытывают сильное отталкивающее действие со стороны положительно заряженных ионов алюминия. Вследствие этого связь
проявляют свойства кислот, так как протоны координационно-связанной воды испытывают сильное отталкивающее действие со стороны положительно заряженных ионов алюминия. Вследствие этого связь  ослабляется, и в раствор переходят ионы гидроксония и гидроксоаквакомплексы алюминия
ослабляется, и в раствор переходят ионы гидроксония и гидроксоаквакомплексы алюминия  и
и  . В нейтральном растворе этот процесс продолжается до образования нейтрального гидроксида алюминия
. В нейтральном растворе этот процесс продолжается до образования нейтрального гидроксида алюминия 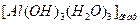 , что выражено следующими уравнениями:
, что выражено следующими уравнениями:



Нейтральный гидроксид алюминия в зависимости от  среды и природы второго компонента, участвующего в реакции, способен диссоциировать или по типу кислот, или по типу оснований, что обусловлено близкими значениями энергии связей между ионами
среды и природы второго компонента, участвующего в реакции, способен диссоциировать или по типу кислот, или по типу оснований, что обусловлено близкими значениями энергии связей между ионами 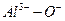 и
и 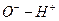 в молекуле
в молекуле  . Действительно, в кислой среде вследствие связывания ионами гидроксония кислоты
. Действительно, в кислой среде вследствие связывания ионами гидроксония кислоты 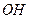 - ионов образуется снова гидратированная соль алюминия:
- ионов образуется снова гидратированная соль алюминия:

Данный процесс протекает ступенчато. В щелочной же среде происходит отщепление протона от четвёртой координационно связанной с катионом алюминия молекулы воды и образование комплексного аниона алюмината 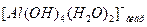 , что схематично можно выразить уравнением:
, что схематично можно выразить уравнением:

Таким образом амфотерные соединения одновременно являются донорами протонов (кислотами) и акцепторами протонов (основаниями), как в приведённом примере; или проявляют электроноакцепторные (кислотные) или электронодонорные функции.
По величинам констант диссоциации можно определить, какие свойства, кислотные или основные, преобладают у данного соединения. Например, простейшая схема диссоциации гидроксида бериллия имеет вид:
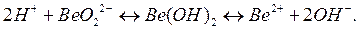
Оба типа диссоциации характеризуются константами диссоциации:
· для кислоты 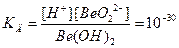
· для основания 
Как видно из приведённых численных значений констант, гидроксид бериллия подвергается диссоциации по типу кислоты и по типу основания в неодинаковой степени, основной тип дип диссоциации преобладает. Следует учитывать, что вследствие образования гидратированных ионов процесс диссоциации протекает несколько более сложно, и амфотерные гидроксиды характеризуются несколькими константами ступенчатой диссоциации. Сравним константы диссоциации некоторых встречающихся в практике химического анализа амфотерных гидроксидов:
| Гидроксид | Косн | Кк-ты |
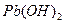
| 
| 
|
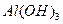
| 
| 
|

| 
| 
|

| 
| 
|

| 
| 
|
Сопоставление приведённых данных показывает, что у одних амфотерных гидроксидов более ясно выражены основные свойства (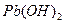 ), у других – кислотные (
), у других – кислотные ( ), а у некоторых кислотные и основные свойства выражены в одинаковой степени (
), а у некоторых кислотные и основные свойства выражены в одинаковой степени ( ).
).
Явление амфотерности широко используется в хмическом анализе. Например, при анализе смеси катионов, образующих нерастворимые в воде гидроксиды, на раствор действуют избытком сильного основания. Если среди выделившихся в осадок соединений имеются амфотерные гидроксиды, то в избытке щёлочи они растворяются. Например в ходе анализа смеси, содержащей ионы 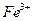 и
и  , при действии избытка щёлочи в осадок выпадает
, при действии избытка щёлочи в осадок выпадает  , а в растворе остаётся
, а в растворе остаётся  . Таким образом, катионы трехвалентного железа можно отделить от катионов алюминия. Аналогичным образом амфотерные гидроксиды
. Таким образом, катионы трехвалентного железа можно отделить от катионов алюминия. Аналогичным образом амфотерные гидроксиды  можно растворить в присутствии других нерастворимых в щелочах гидроксидов. Амфотерные гидроксиды составляют четвёртую аналитическую группу кислотно-основной классификации катионов, поэтому групповым реагентом для данной группы является избыток щёлочи
можно растворить в присутствии других нерастворимых в щелочах гидроксидов. Амфотерные гидроксиды составляют четвёртую аналитическую группу кислотно-основной классификации катионов, поэтому групповым реагентом для данной группы является избыток щёлочи  или
или  . Амфотерность можно использовать не только для отделения амфотерных гидроксидов, но и для проведения проверочных реакций. Например, при открытии ионов бария действием хромата калия в присутствии уксусной кислоты вместе с хроматом бария выпадает осадок хромата свинца, по внешнему виду неотличимый от хромата бария. Чтобы не допустить ошибки, осадок хромата бария и хромата свинца обрабатывают горячим раствором гидроксида натрия. При этом хромат свинца растворяется с образованием плюмбита, а хромат бария остаётся в осадке.
. Амфотерность можно использовать не только для отделения амфотерных гидроксидов, но и для проведения проверочных реакций. Например, при открытии ионов бария действием хромата калия в присутствии уксусной кислоты вместе с хроматом бария выпадает осадок хромата свинца, по внешнему виду неотличимый от хромата бария. Чтобы не допустить ошибки, осадок хромата бария и хромата свинца обрабатывают горячим раствором гидроксида натрия. При этом хромат свинца растворяется с образованием плюмбита, а хромат бария остаётся в осадке.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2419; Нарушение авторских прав?; Мы поможем в написании вашей работы!