
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа. Экспериментальные газовые законы
Идеальный газ – это такой газ, внутренняя энергия которого определяется только кинетической энергией составляющих его молекул. Считают, что в этом случае объем молекул равен нулю. Потенциальной энергией взаимодействия между молекулами и внутримолекулярной энергией можно пренебречь при условии, что такой газ имеет низкую плотность и находится при не слишком высоких температуре и давлении. Этому условию удовлетворяют многие газы при нормальных условиях.
Для описания состояния газа достаточно задать три макроскопических параметра — объем V, давление p и температуру T. Изменение одного из этих параметров вызывает изменение остальных.
Изопроцессы – это процессы, при которых один из параметров p, V или Τ остается постоянным при данной массе газа.
Изотермический процесс – это изопроцесс, происходящий при постоянной температуре: Τ = const.
Закон экспериментально открыли независимо друг от друга английский химик и физик Роберт Бойль (1662) и французский физик Эдм Мариотт (1676).
Закон изотермического процесса (Бойля-Мариотта): для данной массы газа при постоянной температуре произведение давления на объем есть величина постоянная: 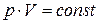 или для двух состояний
или для двух состояний 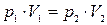
Для осуществления изотермического процесса надо сосуд, наполненный газом, привести в контакт с термостатом.
Термостат – это прибор для поддержания постоянной температуры. Изотермическим процессом приближенно можно считать процесс медленного сжатия или расширения газа в сосуде с поршнем. Термостатом в этом случае служит окружающая среда.
Изобарный процесс – это изопроцесс, происходящий при постоянном давлении: p = const.
Закон экспериментально исследовали независимо друг от друга французские физики Жак Шарль (1787) и Жозеф Гей-Люссак (1802).
Изобарный процесс – это закон Гей-Люссака.
Закон изобарного процесса: при данной массе газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная: 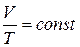 , или
, или  .
.
Этот закон можно записать через температуру t, измеряемую по шкале Цельсия: 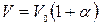 , где V 0 — объем газа при 0 °С, α = 1/273 К-1 — температурный коэффициент объемного расширения.
, где V 0 — объем газа при 0 °С, α = 1/273 К-1 — температурный коэффициент объемного расширения.
При малых плотностях температурный коэффициент объемного расширения не зависит от вида газа, т.е. одинаков для всех газов.
Получить изобарный процесс можно при помощи цилиндра с невесомым поршнем.
Изохорный процесс – это изопроцесс, происходящий при постоянном объеме: V = const.
Закон экспериментально исследовали независимо друг от друга французские физики Жак Шарль (1787) и Жозеф Гей-Люссак (1802).
Изохорный процесс в российских учебниках называют законом Шарля.
Закон изохорного процесса: при данной массе газа при постоянном объеме отношение давления к абсолютной температуре есть величина постоянная:  , или
, или 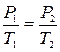 .
.
Если температуру измерять по шкале Цельсия, то закон Гей-Люссака запишется в виде: 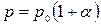 , где p 0 – давление газа при 0 °С, α — температурный коэффициент давления, оказавшийся одинаковым для всех газов: α = 1/273 К-1.
, где p 0 – давление газа при 0 °С, α — температурный коэффициент давления, оказавшийся одинаковым для всех газов: α = 1/273 К-1.
Получить изохорный процесс можно в баллоне, который не изменяет свой объем при данном изменении температуры.
Уравнение состояния идеального газа и вытекающие из него законы Бойля-Мариотта, Гей-Люссака и Шарля достаточно точно описывают поведение реальных газов при небольших давлениях и не слишком низких температурах.
|
Дата добавления: 2014-01-05; Просмотров: 776; Нарушение авторских прав?; Мы поможем в написании вашей работы!