
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная оболочка атома и теория Бора
|
|
|
|
Лекция № 3
Этапы проектирования тепловой защиты здания
Проектирование тепловой защиты здания проводится в следующей последовательности:
1. Определение параметров наружных климатических условий. Методика расчета приведена в разделе 5.1 СП 23-101, исходные данные следует брать из таблицы 1 СНиП 23-01-99;
2. Определение влажностного режима помещений зданий. Методика расчета приведена в разделе 5.2 СП 23-101, исходные данные принимаются для холодного периода в зависимости от типа здания: жилые и общественные здания – по таблице 1 и 2 ГОСТ 30494 (либо таблица 1 СП 23-101) соответственно; для помещений производственного назначения – по ГОСТ 12.1.005;
3. Определение уровня тепловой защиты здания согласно разделу 6 СП 23-101 в соответствии со СНиП 23-02-2003;
4. Проектирование ограждающих конструкций здания:
а) Подбор и выбор наружной строительной конструкции здания;
б) Определение расчетных характеристик строительных материалов и конструкций согласно 5.3 СП 23-101;
в) Сравнение расчетных значений с нормируемыми показателями.
5. В первую очередь непрозрачные наружные ограждения выбирают по нормируемому сопротивлению конструкции здания и по защите от переувлажнения согласно разделу 13 СП 23-101;
6. Выбор светопрозрачных ограждающих конструкций производится по требуемому сопротивлению теплопередаче и воздухопроницаемости – согласно разделу 12 СП 23-101;
7. Расчет теплоустойчивости ограждающих конструкций в летнее время и теплоустойчивости помещений в холодный период времени – согласно разделу 11 СП 23-101;
8. Проектирование конструкций полов по нормируемому значению теплоусвоения – согласно разделу 14 СП 23-101 и в соответствии СНиП 23-02-2003;
9. Составление энергетического паспорта согласно разделу 16 СП 23-101.
Процедура выбора теплозащитных свойств ограждающих конструкций более детально представлена в разделе 6 СП 23-101.
Изолированные атомы разреженного газа или паров металла испускают спектр, состоящий из отдельных спектральных линий. Поэтому спектр испускания атомов называется линейчатым.
Изучение атомных спектров послужило ключом к познанию строения атомов. Было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы или серии.
Исторически первым был изучен спектр атома водорода. В 1885г. швейцарский физик Бальмер установил, что длины волн линий спектра водорода могут быть вычислены по формуле:
 ,
,
где 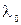 - константа,
- константа,
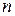 - целое число (
- целое число ( ).
).
В спектроскопии принято характеризовать спектральные линии не частотой, а величиной обратной длине волны  , которую называют волновым числом. С учетом этого понятия предыдущую формулу можно записать в виде
, которую называют волновым числом. С учетом этого понятия предыдущую формулу можно записать в виде
 ,
,
где 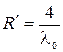 - константа,
- константа,
 .
.
Умножив обе части этого равенства на  , получим
, получим
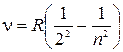 ,
,
где 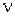 -круговая частота,
-круговая частота,
 ,
,
 - постоянная Ридберга (названа в честь шведского спектроскописта).
- постоянная Ридберга (названа в честь шведского спектроскописта).
Эта формула носит название формула Бальмера, а соответствующая серия спектральных линий атома водорода – серия Бальмера.
Более поздние исследования спектра атома водорода показали, что в нем имеется еще несколько серий. Линии этих серий могут быть представлены в виде формул, аналогичных формуле Бальмера:
серия Лаймана 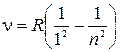 , где
, где  ;
;
серия Пашена 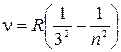 , где
, где 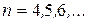 ;
;
серия Брэкета 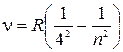 , где
, где 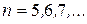 ;
;
серия Пфунда 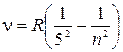 , где
, где  .
.
В общем виде частоты всех спектальных линий водорода можно выразить одной формулой:
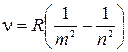 , где
, где 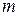 и
и 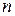 - целые числа.
- целые числа.
Эта формула подтвердилась на опыте с огромной точностью. Таким образом, в этой формуле ясно выступила особая роль целых чисел в спектроскопических закономерностях, осмысленная до конца лишь в квантовой механике.
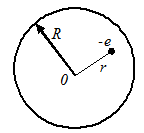 Первая попытка создания на основе накопленных сведений «модели» атома принадлежит Д. Томсону. Он предположил, что атом представляет собой сферу, заполненную положительно заряженной материей, в которой плавает электрон.
Первая попытка создания на основе накопленных сведений «модели» атома принадлежит Д. Томсону. Он предположил, что атом представляет собой сферу, заполненную положительно заряженной материей, в которой плавает электрон.
Суммарный положительный заряд сферы равен заряду электрона, так что атом в целом нейтрален.
Напряженность поля внутри этой сферы, как мы уже знаем из электростатики, равна
 ,
,
где  - радиус сферы;
- радиус сферы;
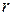 - расстояние от электрона до центра сферы.
- расстояние от электрона до центра сферы.
Согласно определению напряженности электрического поля ( ), сила, действующая на электрон, равна
), сила, действующая на электрон, равна
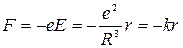 ,
,
где 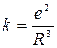 .
.
Таким образом, электрон будет находиться под действием квазиупругой силы, т.е. совершать гармонические колебания около точки «О» с частотой  :
:
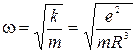 .
.
Пользуясь этой формулой, можно оценить размеры атома, т.е. его радиус:
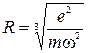 .
.
В видимой области спектра длине волны 0,6 мкм соответствует частота  . Следовательно,
. Следовательно, 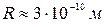 , что по порядку величины согласуется с размерами атомов, полученных из газокинетических расчетов. Это является подтверждением модели Томсона. Однако объяснить с помощью этой модели линейчатый спектр испускания атомов оказалось невозможно. Эта модель не могла также объяснить таблицы Менделеева – периодичности свойств атомов. Таким образом, было очевидно, что модель Томсона неудовлетворительна, и в настоящее время она имеет лишь исторический интерес, как одно из звеньев в цепи развития представлений о строении атомов.
, что по порядку величины согласуется с размерами атомов, полученных из газокинетических расчетов. Это является подтверждением модели Томсона. Однако объяснить с помощью этой модели линейчатый спектр испускания атомов оказалось невозможно. Эта модель не могла также объяснить таблицы Менделеева – периодичности свойств атомов. Таким образом, было очевидно, что модель Томсона неудовлетворительна, и в настоящее время она имеет лишь исторический интерес, как одно из звеньев в цепи развития представлений о строении атомов.
Опыты Резерфорда по рассеянию  - частиц. Ядерная модель атома.
- частиц. Ядерная модель атома.
Для того, чтобы выяснить характер распределения положительных и отрицательных зарядов в атоме, было необходимо опытное «зондирование» внутренних областей атома. Требовались новые эксперименты. Особенно существенными оказались опыты Резерфорда по рассеянию  -частиц в веществе.
-частиц в веществе.
 Напомним, что
Напомним, что  -частицами называют частицы, выбрасываемые с огромной скоростью некоторыми веществами при радиоактивном распаде. Они обладают высокой монохроматичностью и большой массой, т.е. они не отклоняются при столкновениях с электронами, содержащимися в атомах, а отклоняются только при столкновении с положительно заряженной материей атома, масса которой практически равна массе атома. Опыт осуществлялся следующим образом: внутри полости, сделанной в куске свинца, помещалось радиоактивное вещество
-частицами называют частицы, выбрасываемые с огромной скоростью некоторыми веществами при радиоактивном распаде. Они обладают высокой монохроматичностью и большой массой, т.е. они не отклоняются при столкновениях с электронами, содержащимися в атомах, а отклоняются только при столкновении с положительно заряженной материей атома, масса которой практически равна массе атома. Опыт осуществлялся следующим образом: внутри полости, сделанной в куске свинца, помещалось радиоактивное вещество  , служившее источником
, служившее источником  -частиц. На пути этого пучка
-частиц. На пути этого пучка  -частиц располагалась металлическая фольга
-частиц располагалась металлическая фольга  . При прохождении через нее
. При прохождении через нее  -частицы отклонялись от перво-начального направления на различные углы
-частицы отклонялись от перво-начального направления на различные углы  . Рассеянные
. Рассеянные  -частицы ударялись об экран
-частицы ударялись об экран  и вызывали в нем сцинтилляции, т.е. вспышки света, наблюдаемые в микроскоп.
и вызывали в нем сцинтилляции, т.е. вспышки света, наблюдаемые в микроскоп.
Микроскоп и экран можно было вращать вокруг оси, проходящей через фольгу, и устанавливать под любым углом  . Как показали измерения Резерфорда, некоторые
. Как показали измерения Резерфорда, некоторые  -частицы испытывают резкие отклонения от первоначального направления на очень большие углы. Это возможно только в том случае, если внутри атома имеется сильное электрическое поле, созданное зарядом большой массы и сконцентрированным в малом объеме.
-частицы испытывают резкие отклонения от первоначального направления на очень большие углы. Это возможно только в том случае, если внутри атома имеется сильное электрическое поле, созданное зарядом большой массы и сконцентрированным в малом объеме.
Основываясь на этом выводе, Резерфорд предложил в 1911 г. ядерную модель атома. Согласно этой модели атом состоит из положительно заряженного ядра, вокруг которого по замкнутым орбитам движутся электроны. Заряд ядра равен заряду всех электронов. В ядре сосредоточена почти вся масса атома.
Модель Резерфорда явилась существенным шагом вперед, поскольку она представляла атом как динамичную систему движущихся электрических зарядов. Эта модель хорошо объясняла опыты по рассеянию  -частиц веществом и позволяла определить заряд ядра. Было показано, что заряд ядра равен порядковому номеру элемента в системе Менделеева, умноженному на элементарный заряд.
-частиц веществом и позволяла определить заряд ядра. Было показано, что заряд ядра равен порядковому номеру элемента в системе Менделеева, умноженному на элементарный заряд.
Однако модель Резерфорда при ее использовании приводит к ряду затруднений, которые сводятся к следующему: согласно законам классической электродинамики, электроны, двигаясь по кривым орбитам, обладают нормальным ускорением  и, поэтому должны непрерывно излучать электромагнитные волны. Излучение, вызванное вращением электронов вокруг ядра, будет непрерывно уменьшать их энергию. Поэтому они должны непрерывно приближаться к ядру. При этом должны меняться период их обращения и частота излучаемого света. Таким образом, спектр атома Резерфорда должен быть сплошным. На самом деле он линейчатый. Кроме этого, вследствие непрерывной потери энергии электроны должны упасть на ядро. Следовательно, атом долго существовать не может.
и, поэтому должны непрерывно излучать электромагнитные волны. Излучение, вызванное вращением электронов вокруг ядра, будет непрерывно уменьшать их энергию. Поэтому они должны непрерывно приближаться к ядру. При этом должны меняться период их обращения и частота излучаемого света. Таким образом, спектр атома Резерфорда должен быть сплошным. На самом деле он линейчатый. Кроме этого, вследствие непрерывной потери энергии электроны должны упасть на ядро. Следовательно, атом долго существовать не может.
Новые идеи в теорию атомов были внесены Н. Бором.
Постулаты Бора
В 1913 г. датский физик Н.Бор создал первую неклассическую теорию атома. В ее основе лежала идея связать в единое целое три результата, полученные в физике к тому времени: линейчатый спектр атома водорода, ядерную модель атома Резерфорда, квантовый характер излучения и поглощения света.
Для решения этой задачи Бор, сохраняя классический подход к описанию поведения электрона в атоме, выдвинул три постулата, которые называются постулатами Бора.
Первый постулат Бора гласит: в атомах существуют некоторые стационарные состояния, не изменяющиеся во времени без внешних воздействий. В этих состояниях атом не излучает электромагнитных волн.
Второй постулат Бора гласит: в стационарном состоянии атома момент импульса электрона равен целому числу, кратному  , т.е.
, т.е.
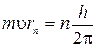 ,
,
где 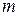 - масса электрона;
- масса электрона;
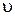 - его скорость;
- его скорость;
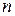 - номер орбиты;
- номер орбиты;
 - ее радиус.
- ее радиус.
Третий постулат Бора гласит: при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии.
Излучение происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией. Этому соответствует переход электрона с орбиты более удаленной от ядра на орбиту более близкую к ядру. Поглощение атомом энергии сопровождается переходом атома из состояния с меньшей энергией в состояние с большей энергией. Этому соответствует переход электрона с орбиты близкой к ядру на более удаленную от ядра орбиту.
Если 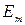 и
и 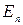 - энергии атома в двух стационарных состояниях, то
- энергии атома в двух стационарных состояниях, то
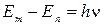 .
.
При 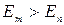 происходит излучение фотона, при
происходит излучение фотона, при 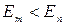 - его поглощение. С помощью этих постулатов был вычислен линейчатый спектр атома водорода. Полученные результаты совпали с опытными данными с большой точностью.
- его поглощение. С помощью этих постулатов был вычислен линейчатый спектр атома водорода. Полученные результаты совпали с опытными данными с большой точностью.
Однако, следует отметить, что постулаты Бора находятся в противоречии с классической механикой и электродинамикой.
Согласно законам классической механики, электрон имеет непрерывную последовательность орбит. Исключение из этого числа орбит, которые не удовлетворяют второму постулату Бора, не может быть объяснено в рамках этой теории.
Законы же электродинамики отрицают возможность устойчивого движения электрона по круговой орбите с ускорением, но без излучения. Экспериментальное подтверждение постулаты Бора нашли в опытах, проводимых Франком и Герцем.
Схема их установки представлена ниже.
 В трубке, заполненной парами ртути под небольшим давлением, помещались три электрода: катод, сетка и анод. Электроны, испускаемые раскаленным катодом, разго-няются электрическим полем, прило-женным между катодом и сеткой, и затем, пройдя сетку, попадают на анод и создают ток в гальванометре. При увеличении потенциала между катодом и сеткой сила тока через гальванометр сначала растет, но при
В трубке, заполненной парами ртути под небольшим давлением, помещались три электрода: катод, сетка и анод. Электроны, испускаемые раскаленным катодом, разго-няются электрическим полем, прило-женным между катодом и сеткой, и затем, пройдя сетку, попадают на анод и создают ток в гальванометре. При увеличении потенциала между катодом и сеткой сила тока через гальванометр сначала растет, но при  резко падает. Дальнейшее увеличение напряжения снова приводит к росту тока через гальванометр, но при
резко падает. Дальнейшее увеличение напряжения снова приводит к росту тока через гальванометр, но при  он снова резко падает и т.д.
он снова резко падает и т.д.
Такой ход кривой объясняется следующим образом: первое резкое падение силы тока при  происходит, потому что возле сетки электроны испытывают неупругие столкновения с атомами паров ртути и теряют свою скорость. Оставшаяся у них энергия недостаточна для преодоления тормозящего поля между сеткой и анодом.
происходит, потому что возле сетки электроны испытывают неупругие столкновения с атомами паров ртути и теряют свою скорость. Оставшаяся у них энергия недостаточна для преодоления тормозящего поля между сеткой и анодом.
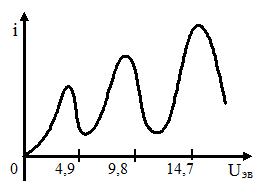 При увеличении ускоряющего поля электроны испытывают неупругие столкновения еще до приближения к сетке, однако потом они вновь ускоряются, и возле сетки их энергия оказывается достаточной для преодоления тормозящего поля между сеткой и анодом. Чем больше скорость, с которой электроны достигают сетки, тем больше будет доля электронов, проскочивших через сетку, и тем больше будет сила тока
При увеличении ускоряющего поля электроны испытывают неупругие столкновения еще до приближения к сетке, однако потом они вновь ускоряются, и возле сетки их энергия оказывается достаточной для преодоления тормозящего поля между сеткой и анодом. Чем больше скорость, с которой электроны достигают сетки, тем больше будет доля электронов, проскочивших через сетку, и тем больше будет сила тока  . Этим объясняется новый подъем тока при увеличении напряжения от
. Этим объясняется новый подъем тока при увеличении напряжения от  до
до 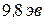 . При дальнейшем увеличении напряжения процесс повторяется снова.
. При дальнейшем увеличении напряжения процесс повторяется снова.
Опыты Франка и Герца подтвердили основное положение квантовой теории атома: в них обнаруживается, что атом не чувствителен к ударам электронов, если они не сообщают ему энергию достаточную для перехода с одного уровня энергии на другой, из одного стационарного состояния в другое.
Опыт Франка и Герца был проделан для паров ртути. В дальнейшем было установлено, что атомы других веществ также поглощают энергию дискретными порциями.
Атом водорода и его спектр по теории Бора
Согласно второму постулату Бора, из всех возможных орбит электрона имеют смысл только те, для которых момент импульса равен целому числу кратному  , т.е.
, т.е.
 ,
,
где 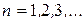 и называется главным квантовым числом.
и называется главным квантовым числом.
Отсюда
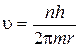 . (1)
. (1)
Рассмотрим электрон, движущийся в поле атомного ядра с ядром 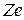 (
( - порядковый номер элемента в периодической системе Менделеева,
- порядковый номер элемента в периодической системе Менделеева, 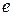 - заряд электрона). При
- заряд электрона). При  такая система соответствует атому водорода. Согласно ІІ-му закону Ньютона произведение массы электрона на его центростремительное ускорение должно равняться кулоновской силе, т.е.
такая система соответствует атому водорода. Согласно ІІ-му закону Ньютона произведение массы электрона на его центростремительное ускорение должно равняться кулоновской силе, т.е.
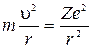 , (2)
, (2)
 ,
, 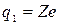 ,
, 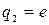 .
.
Откуда
 . (3)
. (3)
Приравнивая (1) и (3), получим
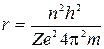 . (4)
. (4)
Для первой орбиты атома водорода  и
и  , тогда
, тогда
 .
.
Внутренняя энергия атома складывается из кинетической энергии электрона и его потенциальной энергии.
Кинетическая энергия электрона
 .
.
Потенциальную энергию электрона можно найти, вспомнив, что работа электрической силы притяжения при удалении электрона от 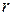 до
до  равна изменению потенциальной энергии с обратным знаком, т.е.
равна изменению потенциальной энергии с обратным знаком, т.е.
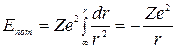
Как следует из формулы (3)
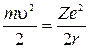 .
.
Следовательно,
 .
.
Подставив в эту формулу значение радиуса 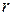 из равенства (4), получим
из равенства (4), получим
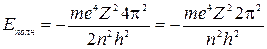 , при
, при 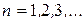 . (5)
. (5)
 Схема энергетических уровней, опре-деляемых этой формулой, представлена на рисунке.
Схема энергетических уровней, опре-деляемых этой формулой, представлена на рисунке.
Т.к. полная энергия атома отрицательна, то, чем меньше ее абсолютное значение, тем больше значение полной энергии. Т.е. с увеличением радиуса орбиты, на которой находится электрон, энергия атома увеличивается.
Пользуясь теорией Бора, можно объяснить происхождение линейчатых спектров.
Для атома водорода эта теория позволила установить соотношения между частотами отдельных линий в спектре, которые ранее были открыты эмпирическим путем. Одно из таких соотношений, как мы уже знаем, было установлено Бальмером. В видимой части спектра частоты колебаний подчиняются формуле
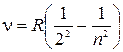 ,
, 
Теория Бора позволяет объяснить происхождение серии Бальмера.
Согласно ІІІ-му постулату Бора излучение энергии атомом происходит в согласии с условием
 ,
,
где  и
и  - дискретные значения уровней энергии атома.
- дискретные значения уровней энергии атома.
Для двух уровней энергии атома  и
и 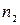 , согласно формуле (5), при
, согласно формуле (5), при 
 ;
;
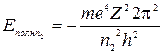 .
.
Тогда
 .
.
Откуда
 .
.
Обозначив  через
через  , получим
, получим  .
.
Полагая в этой формуле 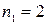 и
и  , получим группу линий, образующих серию Бальмера. Частоты этих линий соответствуют частотам излучения атома водорода при переходе электрона с третьей, четвертой, пятой и т.д. орбит на вторую.
, получим группу линий, образующих серию Бальмера. Частоты этих линий соответствуют частотам излучения атома водорода при переходе электрона с третьей, четвертой, пятой и т.д. орбит на вторую.
Давая  значение 1, и, полагая
значение 1, и, полагая  , получим серию Лаймана, расположенную в ультрафиолетовой части спектра. Эта серия образуется при переходах электрона с удаленных орбит на первую.
, получим серию Лаймана, расположенную в ультрафиолетовой части спектра. Эта серия образуется при переходах электрона с удаленных орбит на первую.
Когда 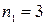 и
и  , получаем еще одну серию – серию Пашена, расположенную в инфракрасной части спектра.
, получаем еще одну серию – серию Пашена, расположенную в инфракрасной части спектра.
Таким образом, теория Бора, объяснившая состав спектра и механизм образования спектральных линий атома водорода и водородоподобных ионов, оказалась крупным шагом в развитии теории атома. Она показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире.
В течении последующего десятилетия теория Бора была подвергнута дальнейшему развитию и уточнению, и выяснились некоторые ее недочеты. Одним из недостатков теории Бора явилась невозможность создания теории атома гелия – одного из простейших атомов, непосредственно следующего за атомом водорода.
Самой слабой стороной теории Бора была ее внутренняя логическая противоречивость, т.к. она не была ни последовательно классической, ни последовательно квантовой теорией. В настоящее время, после открытия своеобразных волновых свойств веществ, стало совершенно ясно, что теория Бора, опирающаяся на классическую механику, могла быть только переходным этапом на пути к созданию последовательной теории атомных явлений.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 521; Нарушение авторских прав?; Мы поможем в написании вашей работы!