
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Дальтона
|
|
|
|
Закон Шарля
Аналогичным образом, для процесса, протекающего при постоянном объеме, мы можем получить:
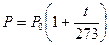 .
.
Это закон Шарля.
При выводе уравнения состояния идеального газа мы не пользовались предположением о том, что все молекулы одинаковы. Поэтому полученное уравнение применимо и для смеси газов (фактически это следствие того, что мы не учитывали характер взаимодействия молекул между собой, а вернее, совсем им пренебрегли).
Пусть смесь газов находится в одном объеме при температуре 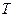 .
. 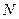 - общее число молекул смеси газов, причем,
- общее число молекул смеси газов, причем,  , где
, где 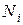 - число молекул каждого газа составляющего рассматриваемую смесь. Для этого случая уравнение состояния идеального газа будет иметь вид:
- число молекул каждого газа составляющего рассматриваемую смесь. Для этого случая уравнение состояния идеального газа будет иметь вид:
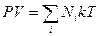 .
.
Но для каждой из компонент составляющих смесь газов мы можем записать 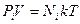 . Поэтому, суммируя по всем молекулам, получим:
. Поэтому, суммируя по всем молекулам, получим:
 .
.
Таким образом, имеем:
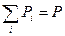 ,
,
т.е. давление смеси газов равно сумме давлений каждого газа, если бы он один занимал весь объем 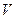 . Это закон Дальтона. Давления
. Это закон Дальтона. Давления 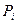 называются парциальными давлениями.
называются парциальными давлениями.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 460; Нарушение авторских прав?; Мы поможем в написании вашей работы!