
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Агрегатные состояния вещества. Уравнение Ван дер Ваальса. Фазовые переходы
|
|
|
|
По мере увеличения плотности газа становится существенным взаимодействие между молекулами. Увеличение давления может сопровождаться превращением газа в жидкость, среду со свойствами существенно отличными от свойств газа, тем более идеального газа.
Эти явления связаны с взаимодействием молекул между собой. Выяснить в деталях характер этого взаимодействия в данном разделе физики не представляется возможным, однако, можно привести факты, а в дальнейшем их использовать, показывающие, что на близких расстояниях молекулы отталкиваются (газ нельзя сжать до бесконечно малого объема, а на больших – притягиваются (жидкость не распадается на молекулы, самопроизвольно не превращается в пар).
Учтем эти силы в уравнение состояния идеального газа:
- силы отталкивания не позволяют сжать газ до бесконечно малого объема, поэтому, вместо 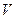 в уравнении
в уравнении 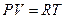 , запишем
, запишем 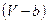 . При этом получим
. При этом получим 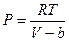 . Видно, что при
. Видно, что при 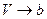
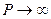 ,
,
- силы притяжения уменьшают давление, т.к. они стремятся сжать газ. Поправку к давлению учтем следующим образом. На каждую молекулу действует сила пропорциональная плотности газа 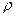 ~
~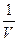 , где
, где 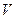 -объем, но давление тем меньше, чем больше молекул, т.е. опять имеем пропорциональность
-объем, но давление тем меньше, чем больше молекул, т.е. опять имеем пропорциональность 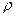 . Таким образом поправка к давлению ~
. Таким образом поправка к давлению ~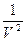 . Обозначим эту поправку как
. Обозначим эту поправку как 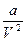 , где
, где 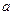 - некоторая константа, характеризующая силы притяжения молекул. Поэтому имеем:
- некоторая константа, характеризующая силы притяжения молекул. Поэтому имеем:
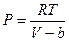 -
-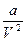
или, для одного моля вещества, получаем:
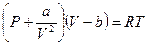 .
.
Это уравнение состояния реального газа или, как его еще называют, уравнение Ван дер Ваальса. Коэффициенты 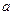 и
и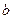 называются константами Ван дер Ваальса. Они зависят от типа газа.
называются константами Ван дер Ваальса. Они зависят от типа газа.
При малых плотностях газа, когда 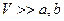 , поправками Ван дер Ваальса можно пренебречь и получить уравнение состояния идеального газа.
, поправками Ван дер Ваальса можно пренебречь и получить уравнение состояния идеального газа.
Представим полученное уравнение в виде:
 .
.
Это уравнение третей степени, следовательно, оно имеет три корня. Анализ показывает, что отрицательных корней нет, а корни либо все три действительные, либо один действительный и два комплексно сопряженных.
 На
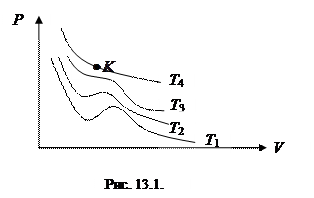
На  -диаграмме (рис. 13.1) представлены изотермы Ван дер Ваальса для различных температур:
-диаграмме (рис. 13.1) представлены изотермы Ван дер Ваальса для различных температур:  .
.
Видим, что при низких температурах изотермы реального газа существенно отличаются от изотермы идеального газа.
Рассмотрим на изотерме реального газа (рис. 13.2) следующие участки:
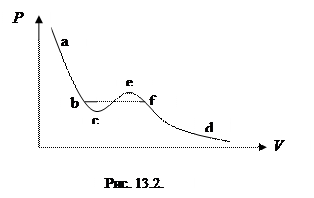 |
(a-c) и (e-d) - на этих участках с ростом объема уменьшается давление, что находится в соответствии с экспериментом.
(с-e) – этот участок изотермы на практике не реализуется.
Как показывает опыт реальной изотерме Ван дер Ваальса соответствует кривая (a-b-f-d).
Участок (a-b) соответствует газообразному состоянию, (f-d) – жидкому, горизонтальный участок (b-f) - переходному двухфазовому состоянию вещества, в котором две фазы жидкая и газообразная находятся одновременно. Причем для данного вещества этому переходу соответствует определенное давление, определяемое температурой.
Участки (e-f) и (b-c) отвечают метастабильным состояниям: переохлажденному пару (газу) и перегретой жидкости соответственно.
При повышении температуры прямолинейный участок (b-f) сужается до точки (К). Это критическая точка (см. рис.13.1). В этой точке при фазовом переходе объем сохраняется, а производная  . Температура, при которой это происходит называется критической (
. Температура, при которой это происходит называется критической (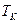 ). При
). При  - преобразования фазовых состояний нет, существует только газообразная фаза. При
- преобразования фазовых состояний нет, существует только газообразная фаза. При 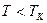 возможно существование как жидкой, так и газообразной фаз.
возможно существование как жидкой, так и газообразной фаз.
Из изотерм Ван дер Ваальса видно, как сделать газ жидкостью. Для этого необходимо охладить газ до температуры ниже критической и потом сжать.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 761; Нарушение авторских прав?; Мы поможем в написании вашей работы!