
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тройная точка
|
|
|
|
На (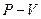 ) диаграмме (см. рис. 13.1 и 13.2) есть участок, на котором (при
) диаграмме (см. рис. 13.1 и 13.2) есть участок, на котором (при 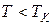 ) жидкая и газообразная фазы находятся в равновесии, при этом каждой температуре соответствует единственное давление.
) жидкая и газообразная фазы находятся в равновесии, при этом каждой температуре соответствует единственное давление.
Построим кривую зависимости давления от температуры (см. рис. 14.3), при которых имеет место равновесие этих двух фаз состояния вещества. Эта кривая заканчивается в точке 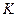 (критическая точка), которой соответствует критическая температура. При температуре выше критической изотермы похожи на изотермы идеального газа – взаимодействие между молекулами достаточно слабое.
(критическая точка), которой соответствует критическая температура. При температуре выше критической изотермы похожи на изотермы идеального газа – взаимодействие между молекулами достаточно слабое.
Можно также построить зависимость между давлением и температурой, при которых твердая и жидкая фазы вещества находятся в равновесии. Эти две кривые пересекутся в некоторой точке (тройная точка). В этой точке все три фазы состояния вещества будут находиться в равновесии. Мы получили фазовую диаграмму вещества. Участок, соответствующий переходу твердое тело – жидкость, называется кривой плавления.
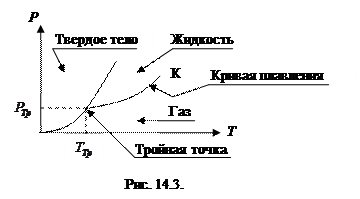 |
Из фазовой диаграммы видно, что вещество при нагревании не обязательно из твердой фазы переходит в жидкую. При температуре ниже температуры, соответствующей тройной точке, снижение давления приводит к переходу твердого тела в газообразное состояние, а при давлении ниже давления, соответствующего тройной точке, повышение температуры – к аналогичному переходу. Это явление называется сублимацией или возгонкой. Твердая углекислота при атмосферном давлении сублимирует, т.к. ее тройной точке соответствует давление 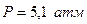 и температура
и температура  .
.
Кривая равновесия газообразной и жидкой фазы заканчивается в критической точке  . Далее существует либо только газ, либо только жидкость. Кривая же равновесия твердого тела и газа уходит в начало координат – при температуре нуль градусов Кельвина все вещества находятся в твердом состоянии. Это обстоятельство согласуется с понятием температуры как меры кинетической энергии движения молекул. При
. Далее существует либо только газ, либо только жидкость. Кривая же равновесия твердого тела и газа уходит в начало координат – при температуре нуль градусов Кельвина все вещества находятся в твердом состоянии. Это обстоятельство согласуется с понятием температуры как меры кинетической энергии движения молекул. При  , кинетическая, а, следовательно, и внутренняя энергия движения молекул, атомов должна обращаться в нуль и основным фактором становится потенциальная энергия взаимодействия атомов (молекул). При этом атомы (молекулы) располагаются таким образом, чтобы потенциальная энергия была минимальной, что определяет некоторый порядок в их расположении – образуется кристаллическая решетка. При абсолютном нуле вещество должно быть кристаллическим.
, кинетическая, а, следовательно, и внутренняя энергия движения молекул, атомов должна обращаться в нуль и основным фактором становится потенциальная энергия взаимодействия атомов (молекул). При этом атомы (молекулы) располагаются таким образом, чтобы потенциальная энергия была минимальной, что определяет некоторый порядок в их расположении – образуется кристаллическая решетка. При абсолютном нуле вещество должно быть кристаллическим.
14.5. Кристаллические модификации
Под твердыми телами обычно понимают кристаллические тела, хотя такие вещества как стекло, вар, пластмассы тоже могут считаться твердыми, однако, с физической точки зрения они являются переохлажденными жидкостями, стекло, например, течет даже при нормальных условиях, но очень медленно. В отличие от твердых тел, они называются аморфными.
В твердом состоянии одно и тоже вещество может иметь различные кристаллические, т.е. находиться в различных фазовых состояниях. Эти фазы называются кристаллическими модификациями. Свойства тел обладать различными кристаллическими модификациями называется полиморфизмом. Примером полиморфного твердого тела является углерод, который может существовать в виде алмаза или графита.
Как и всякие фазы состояния вещества, различные кристаллические модификации могут находиться в равновесии лишь вдоль определенной линии на ( ) диаграмме. Переход одной фазы в другую называется полиморфным превращением, которое сопровождается выделением или поглощением тепла.
) диаграмме. Переход одной фазы в другую называется полиморфным превращением, которое сопровождается выделением или поглощением тепла.
В качестве примера, приведем фазовую диаграмму углерода, на которой область газообразного состояния лежит при малых давлениях и при таком масштабе не видна.
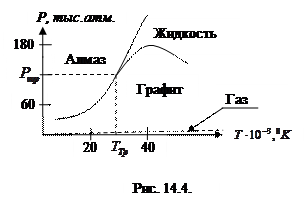 |
Из диаграммы видно, что при нормальных давлениях и температурах устойчивым состоянием является только графит. Однако, известно, что алмаз при этих же условиях так же существует. Это широко известное явление метастабильной кристаллической модификации. Переход из одного состояния в другое (алмаз – графит) затруднено из-за относительной устойчивости кристаллической решетки алмаза. Однако, если нагреть алмаз до температуры 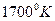 , то он превращается в графический порошок. Обратный процесс превращения графита в алмаз может происходить только при очень высоких давлениях. Область устойчивости для алмаза начинается при
, то он превращается в графический порошок. Обратный процесс превращения графита в алмаз может происходить только при очень высоких давлениях. Область устойчивости для алмаза начинается при 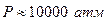 , причем, для того, чтобы процесс превращения графита в алмаз шел достаточно быстр, необходима высокая температура. Если использовать металлический катализатор, то процесс идет при
, причем, для того, чтобы процесс превращения графита в алмаз шел достаточно быстр, необходима высокая температура. Если использовать металлический катализатор, то процесс идет при  и
и 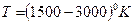 .
.
Искусственные алмазы широко используются в промышленном производстве режущих и шлифовальных инструментов.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!