
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический состав белков
|
|
|
|
Основные свойства белка зависят от их химического строения. Белки представляют собой высокомолекулярные соединения, молекулы которых построены их остатков альфа-аминокислот, т.е. аминокислот, у которых первичная аминогруппа и карбоксильная группа связаны с одним и тем же углеродным атомом (первым атомом углерода, считая от карбонильной группы).
Из белков путем гидролиза выделяют 19-32 вида альфа-аминокислот, но обычно получают 20 альфа-аминокислот (это так называемые протеиногенные аминокислоты). Общая их формула:
 |
общая часть для всех аминокислот
R - радикал, т.е. группировка атомов в молекуле аминокислоты, связанная с альфа-углеродным атомом и не принимающая участие в формировании хребта полипептидной цепи.
Среди продуктов гидролиза многих белков обнаружены пролин и оксипролин, которые содержат иминогруппу =NН, а не аминогруппу Н2N- и собственно являются иминокислотами, а не аминокислотами.
Аминокислоты – бесцветные кристаллические вещества, плавящиеся с разложением при высоких температурах (выше 250°С). Легко растворимы, в большинстве своем, в воде и не растворимы в эфире и др. органических растворителях.
Аминокислоты содержат одновременно две группы, способные к ионизации: карбоксильную, обладающую кислотными свойствами, и аминогруппу, обладающую основными свойствами, т.е. аминокислоты являются амфотерными электролитами.
В сильнокислых растворах аминокислоты присутствуют в виде положительно-заряженных ионов, а в щелочных растворах – в виде отрицательных ионов.
В зависимости от значения рН среды любая аминокислота может обладать то положительным, то отрицательным зарядом.
Значение рН среды, при котором частицы аминокислот электронейтральны, обозначается как их изоэлектрическая точка.
Все получаемые из белков аминокислоты, за исключением глицина, оптически активны, так как они содержат в альфа-положении асимметрический атом углерода.
Из 17 оптически-деятельных белковых аминокислот 7 характеризуется правым /+/ и 10 – левым /-/ вращением плоскости поляризованного луча, но все они относятся к L-ряду.
В некоторых природных соединениях и биологических объектах (к примеру, в бактериях и в составе антибиотиков грамицидина и актиномицина) обнаружены аминокислоты D-ряда. Физиологическое значение D- и L-аминокислот различно. Аминокислоты D-ряда, как правило, или совершенно не усваиваются животными и растениями, или усваиваются плохо, поскольку ферментные системы животных и растений специфически приспособлены к L-аминокислотам. Примечательно, что оптические изомеры можно различить по вкусу: аминокислоты L-ряда горькие или безвкусные, а аминокислоты D-ряда – сладкие.
Для всех групп аминокислот характерны реакции, в которых принимают участие аминогруппы или карбоксильные группы, или те и другие одновременно. Кроме того, радикалы аминокислот способны к разнообразным взаимодействиям. Радикалы аминокислот вступают в реакции:
- солеобразования;
- окислительно-восстановительные реакции;
- реакции ацилирования;
- этерификации;
- амидирования;
- фосфорилирования.
Эти реакции, приводящие к образованию окрашенных продуктов, широко применяют для идентификации и полуколичественного определения индивидуальных аминокислот и белков, к примеру, ксантопротеиновая реакция (амидирования), Миллона (солеобразования), биуретовая (солеобразования), нингидриновая реакция (окисления) и др.
Физические свойства радикалов аминокислот также весьма разнообразны. Это касается, прежде всего, их объема, заряда. Разнообразие радикалов аминокислот по химической природе и физическим свойствам обусловливает полифункциональные и специфические особенности образуемых ими белков.
Классификацию аминокислот, встречающихся в белках, можно проводить по различным признакам: по строению углеродного скелета, по содержанию -СООН и Н2N-групп и др. Наиболее рациональна классификация, основывающаяся на различиях в полярности радикалов аминокислот при рН 7, т.е. при значении рН, соответствующем внутриклеточным условиям. В соответствии с этим аминокислоты, входящие в состав белков, можно подразделить на четыре класса:
-аминокислоты с неполярными радикалами;
- аминокислоты с незаряженными полярными радикалами;
- аминокислоты с отрицательно заряженными полярными радикалами;
- аминокислоты с положительно заряженными полярными радикалами
Рассмотрим строение этих аминокислот.
Аминокислоты с неполярными R-группами (радикалами)
В этот класс входят четыре алифатические аминокислоты (аланин, валин, изолейцин, лейцин), две ароматические аминокислоты (фенилаланин, триптофан), одна серосодержащая аминокислота (метионин), и одна иминокислота (пролин). Общим свойством этих аминокислот является их более низкая растворимость в воде по сравнению с полярными аминокислотами. Структура их такова:

Аланин (α-аминопропионовая кислота)
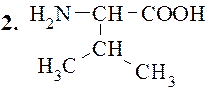
Валин (α-аминоизовалериановая кислота)
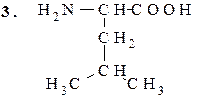
Лейцин (α-аминоизокапроновая кислота)

Изолейцин (α-амино-β-метилвалериановая кислота)
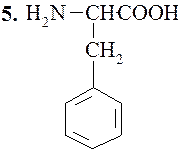
Фенилаланин (α-амино-β-фенилпропионовая кислота)
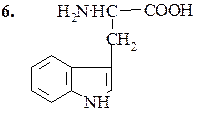 |
Триптофан (α-амино-β-индолпропионовая кислота)
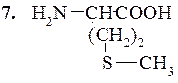
Метионин (α-амино-γ-метил-тиомаслянная кислота)

Пролин (пирролидин-α-карбоновая кислота)
2. Аминокислоты с незаряженными полярными R‑группами (радикалами)
Этот класс включает одну алифатическую аминокислоту – глицин (гликокол), две гидроксиаминокислоты – серин и треонин, одну серосодержащую аминокислоту – цистеин, одну ароматическую аминокислоту – тирозин, и два амида – аспарагин и глутамин.
Эти аминокислоты более растворимы в воде, чем аминокислоты с неполярными R‑группами, так как их полярные группы могут образовывать водородные связи с молекулами воды. Структура их такова:
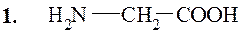
Глицин или гликокол (α-аминоуксусная кислота)

Серин (α-амино-β-гидроксипропионовая кислота)

Треонин (α-амино-β-гидроксимаслянная кислота)
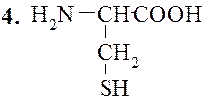
Цистеин (α-амино-β-тиопропионовая кислота)
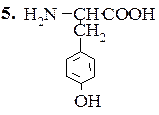
Тирозин (α-амино-β-парагидроксифенилпропионовая кислота)
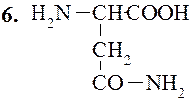
Аспарагин

Глутамин
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1224; Нарушение авторских прав?; Мы поможем в написании вашей работы!