
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь
|
|
|
|
Виды химических связей
Лекция № 2
· Виды связей в органических соединениях. Волновое уравнение, волновая функция, атомные орбитали и их типы. Природа ковалентных связей. Типы молекулярных орбиталей.
· Электронная конфигурация и гибридизация углерода в органических соединениях. s- и p-Связи в органических соединениях, их характеристики: энергия, длина, полярность, поляризуемость.
Известно несколько видов химических связей: ионная, ковалентная, металлическая, водородная. Органические соединения образованы почти исключительно за счет ковалентных связей.
Движение электрона в зависимости от его энергии описывается уравнением Э. Шрёдингера (1926 г.) (1)
| -h2 | ∂2 ψ | + | ∂2 ψ | + | ∂2 ψ | + | U ψ | = | E ψ | (1) | |||
| 8p2m | ∂x2 | ∂y2 | ∂z2 |
где:m – масса электрона; h – постоянная Планка; U – потенциальная энергия системы; Е – полная энергия системы; x,y,z – координаты; ψ – волновая функция.
Решение уравнения Шрёдингера дает области, в которых может находиться электрон во время своего движения в атоме. Квадрат модуля волновой функции |ψ|2Dt - вероятность нахождения электрона в объеме пространства. Объем, в котором вероятность нахождения электрона 95%, называется орбиталью.
Формы и расположение s -, p - и d -орбиталей известны из курса общей химии.
При образовании ковалентной связи верхние электронные оболочки атомов заполняются за счет обобществления электронных пар двумя (или несколькими) атомами.
Образование ковалентной связи при перекрывании атомной орбитали (АО) одного атома с АО другого. Чаще всего каждая орбиталь несет по одному электрону. Обобществленную электронную пару изображают линией, соединяющей связанные атомы. «Обобществленная» означает, что невозможно определить, какому из атомов принадлежит конкретный электрон. Пара электронов принадлежит одновременно каждому из атомов, образовавших связь.
A· + Б· ® А ·· Б или А—Б (структура Льюиса)
Другой способ образования ковалентной связи: один атом предоставляет АО с парой электронов, другой атом – свободную (вакантную) АО.
А·· + Б ® А—Б
Рассмотрим простейший пример – образование молекулы водорода. Два атома водорода образуют молекулу Н2, отдавая по одному электрону, в результате каждому из атомов водорода принадлежит пара электронов, следовательно, их электронные оболочки завершены.
Н● + ●Н → Н—Н
При образовании ионной связи валентность атома легко предсказать, зная его положение в периодической системе элементов. Сложнее обстоит дело с ковалентной связью, поскольку она может образовываться разными способами.
Правило максимальной ковалентности:
· водород может быть только одноковалентен (не более электронов);
· элементы первого короткого периода (от Li до F) могут образовывать не более четырех ковалентных связей (не более 8 электронов);
· элементы от Na до Br (включительно) – не более шести ковалентных связей (не более 12 электронов);
· остальные не более 8 ковалентных связей (не более 16 электронов).
Образование молекулярных орбиталей из АО (ЛКАО МО)
При образовании ковалентной связи (связей) перекрывание любого числа АО приводит к образованию такого же числа молекулярных орбиталей (МО). Отличие МО от АО в том, что они охватывают не одно ядро, а два (или большее число) ядер атомов.
При взаимодействии двух атомов одного элемента (энергия электронов одинакова) происходит образование двух локализованных МО, отличающихся по энергии.
Орбиталь, имеющая меньшую энергию, называется связывающей МО (МОсв). На ней располагается пара электронов ковалентной связи. Связь образуется за счет выигрыша в энергии. Энергия второй МО выше энергии АО. Электроны могут находиться на ней только в возбужденном состоянии. Эту МО называют разрыхляющей (МО*).
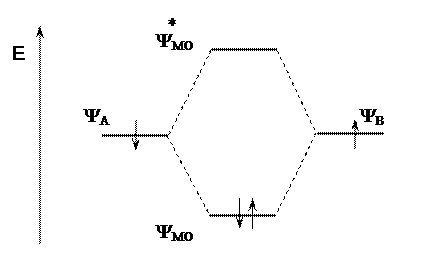
Рис. 2. Образование и энергии атомных и молекулярных орбиталей
У связывающей МО электронная плотность в пространстве между ядрами повышена, у разрыхляющей МО в пространстве между ядрами она отсутствует. Ковалентная связь – пара электронов находится на связывающей МО.
По такому же принципу образуются ковалентные связи между атомами разных элементов, а также в случае, когда один из атомов отдает пару электронов, а второй - свободную орбиталь.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 357; Нарушение авторских прав?; Мы поможем в написании вашей работы!