
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівняння стану ідеального газу
|
|
|
|
Кінетична теорія газів
Реальні гази
З. Явища переносу
Ефективний діаметр, число зіткнень і середня довжина вільного пробігу мо-лекул. Явища переносу в газах. Рівняння переносу. Молекулярно-кінетичне трактування явищ переносу. Коефіцієнти переносу і їх аналіз.
Рівняння стану реального газу (рівняння Ван-дер-Ваальса). Критичний стан. Внутрішня енергія реального газу.
Загальні положення
Молекулярна фізика вивчає будову і властивості речовини, виходячи з молекулярно-кінетичних уявлень, що
1) будь-яке тіло складається з великої кількості молекул;
2) молекули будь-якої речовини знаходяться у стані постійного теплового руху;
3) молекули взаємодіють між собою.
Молекулярна фізика розглядає властивості речовини як підсумковий результат дії молекул. При цьому вона користується статистичним методом, цікавлячись лише середніми величинами (середня швидкість молекул, середня енергія і т.п.)
Термодинаміка вивчає властивості тіл і явищ природи не цікавлячись їх мікроскопічною структурою. В основі термодинаміки лежать кілька фундаментальних законів, які виведені шляхом узагальнення великої сукупності експериментальних даних.
Підходячи до зміни стану речовини з різних точок зору (молекулярна фізика з мікроскопічного рівня, термодинаміка – з макроскопічного), вони взаємно доповнюють одна одну.
У молекулярно – кінетичній теорії користуються моделлю ідеального газу, що задовільняє таким умовам:
1) власний об’єм молекул нехтовно малий порівняно з об’ємом посудини;
2) між молекулами газу відсутні сили взаємодії;
3) зіткнення молекул газу між собою і з стінками посудини абсолютно пружні.
Рівняння стану ідеального газу називають рівнянням Клапейрона-Менделєєва. У розрахунку на 1 моль ідеального газу рівняння Клапейрона –Менделєєва записують так:
PV=RT, (2.1)
а для будь-якої маси m –так:
PV=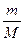 RT, (2.2)
RT, (2.2)
де М -маса, яку має моль газу,
Р - тиск газу,
V - об’єм газу,
Т - температура газу,
R -універсальна газова стала, R =8, 31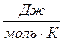 .
.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 483; Нарушение авторских прав?; Мы поможем в написании вашей работы!