
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закони електролізу. Застосування електролізу
|
|
|
|
Для кожного хімічного елемента можна у виразі (4.3.3) виділити сталу величину k, яку називають електрохімічним еквівалентом речовини:
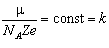 . (4.3.4)
. (4.3.4)
У СІ електрохімічний еквівалент вимірюють у кілограмах на кулон: [ k ] = кг/Кл.
Виходячи з цього можна записати, що m = kq = kI ∆ t. (4.3.5)
Маса речовини, яка виділяється на катоді за час ∆ t, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Електрохімічний еквівалент речовини визначено для всіх хімічних елементів. Він є табличною величиною, але його не важко розрахувати:  , де
, де  - хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
- хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
F = NAe = 6,02·1023 1/моль ×1,6·10 -19 Кл = 96500 Кл/моль.
Стала Фарадея дорівнює заряду, під час перенесення якого одновалентними іонами через розчин або розплав електроліту виділяється 1 моль речовини.
З цих міркувань вираз (4.3.4) набуде вигляду:  . (4.3.6)
. (4.3.6)
Формула (4.3.6) виражає другий закон Фарадея для електролізу: електрохімічні еквіваленти різних речовин прямо пропорційні їх хімічним еквівалентам. Якщо у вираз (4.3.5) підставити співвідношення (4.3.4), то отримаємо об'єднаний закон Фарадея для електролізу:  .
.
Явище електролізу має широке застосування в електрометалургії (добування чистих металів); у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1223; Нарушение авторских прав?; Мы поможем в написании вашей работы!