
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантові постулати Бора
|
|
|
|
Тріумф класичної фізики в поясненні складної будови мікросвіту, який привів Е. Резерфорда до створення ядерної моделі атома, тривав недовго. За першої ж спроби застосувати закони класичної механіки та електродинаміки до опису найпростішого атома Гідрогену фізики зіткнулися з труднощами, які здавалися нездоланними.
Як відомо, атом Гідрогену є стійким утворенням, яке складається з ядра-протона й одного електрона, що обертається навколо нього під дією кулонівської сили взаємодії (мал. 7.4). Якщо вважати орбіту електрона коловою, то: 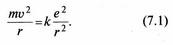


З електродинаміки відомо, що електрон, який рухається з прискоренням, має випромінювати електромагнітні хвилі і поступово втрачати енергію, тобто з часом він мав би впасти на ядро, а атом — припинити існування. Отже, за класичними міркуваннями, атоми мають бути нестійкими утвореннями, які весь час випромінюють суцільний спектр електромагнітних хвиль. Проте цей висновок суперечить практиці, адже насправді атоми «живуть» тривалий час і випромінюють енергію лише за певних умов.
Поклавши, що розмір атома r» 10-10 м, швидкість електрона дорівнюватиме v» 106 мс —, а його прискорення а «1022 мс.
Квантові постулати Н. Бора усувають протиріччя між твердженнями класичної теорії і наявним результатом тривалого існування атомів. Це протиріччя між класичною теорією і практикою спробував пояснити у 1913 р. відомий датський учений Нільс Бор, який сформулював квантові постулати:
1) атоми перебувають у певних стаціонарних станах, в яких вони не випромінюють електромагнітні хвилі;
2) під час переходу атома з одного стаціонарного стану, що характеризується енергією Еn, в інший з енергією Еm, він випромінює або поглинає квант енергії, що дорівнює
hn= En - Em. (7.2).
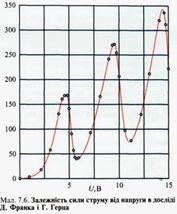
Перший постулат Н. Бора, який спростовував фундаментальні положення класичної фізики, був експериментально підтверджений у 1913р. дослідами Д.Франка і Г.Герца, які досліджували залежність сили струму від напруги у скляній колбі, заповненій парою ртуті (мал. 7.5). Джерело струму Е створює напругу, завдяки якій електрони прямують до анода з прискоренням. Електрони з катода К під дією електричного поля, створеного між електродами джерелом струму Е, прямують до сітки С й анода А. Між сіткою С й анодом А існує незначна напруга (0,5 В), яка гальмує повільні електрони, перешкоджаючи їх руху до анода. Результати дослідження залежності сили струму I в колі анода від напруги U показали, що ця залежність має нелінійний складний характер (див. мал. 7.6). Існування максимумів струму за напруг 4,9; 9,8 і 14,7 В можна пояснити лише однією причиною — існуванням в атомів Меркурію стаціонарних станів. Справді, за напруги U<4,9 В електрони, що вилетіли з катода, зіткнувшись з атомами Меркурію, практично не змінюють своєї енергії (адже mе < МHg) і легко долають гальмівну напругу між сіткою й анодом. За напруги U= 4,9 В відбувається їх непружне зіткнення й електрони втрачають енергію, збуджуючи атоми Меркурію; їхньої енергії недостатньо для подолання гальмівної напруги і сила струму в колі анода різко спадає. В міру подальшого зростання напруги між катодом К і сіткою С сила анодного струму знову зростає, досягаючи максимуму за 9,8 В, тобто енергія атома Меркурію змінюється на 4,9 еВ.
У дослідах Д. Франка і Г. Герца залежність сили струму від напруги не лінійна: за певної напруги існують максимальні значення струму. Електрон-вольт (еВ) — це енергія, якої набуває електрон під дією прискорювальної напруги 1 В: 1 еВ = 1,6 · 10-19Дж.
У збудженому стані атоми можуть перебувати дуже короткий час (~10-8 с), після чого самочинно повертаються в основний незбуджений стан, випромінюючи світловий квант частотою 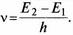 . У дослідах Д. Франка і Г. Герца за напруги 4,9 В спостерігалося ультрафіолетове світіння пари ртуті, що остаточно підтвердило справедливість квантових постулатів Н. Бора.
. У дослідах Д. Франка і Г. Герца за напруги 4,9 В спостерігалося ультрафіолетове світіння пари ртуті, що остаточно підтвердило справедливість квантових постулатів Н. Бора.
Лінії атомних спектрів утворюють серії, які підлягають певним закономірностям. Так, для видимої частини спектру Гідрогену спектральні лінії утворюють серію Бальмера.
В інфрачервоній частині спектру для значень m = 3 і n = 4, 5, 6,... виявлено лінії так званої серії Пашена.
Другий постулат Бора пояснював закономірності лінійчастих спектрів, природу яких класична фізика не змогла розкрити. У 1885 р. швейцарський учений Й. Бальмер встановив, що довжини хвиль спектральних ліній Гідрогену співвідносяться між собою з певною закономірністю: 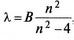 де n = 3, 4, 5, 6; В — стала, що дорівнює 364,56 нм.
де n = 3, 4, 5, 6; В — стала, що дорівнює 364,56 нм.
Згодом, у 1890 p., шведський фізик Й. Рідберг одержав більш загальну формулу для частот спектральних ліній атома Гідрогену:
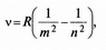 де R = 3,29 · 1015Гц.
де R = 3,29 · 1015Гц.
За цією формулою для ліній серії Бальмера m = 2, n = 3, 4, 5, 6; для ліній серії Пашена m = 3, n = 4, 5, 6,....
Отже, квантові постулати Бора остаточно розв'язали труднощі класичної фізики щодо будови речовини. Вони пов'язали між собою ядерну модель атома Резерфорда, побудовану на основі класичної теорії, і квантовий характер змін внутрішнього стану атома, що було підтверджено експериментально, їхнє значення для розвитку сучасної фізики з'ясувалося згодом, під час становлення квантової механіки, в основу якої покладено ідею квантування значень фізичних величин.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 869; Нарушение авторских прав?; Мы поможем в написании вашей работы!