
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронный курс лекций
|
|
|
|
Методы анализа сырья и пищевых продуктов
(в авторской редакции)
Содержание
Введение к курсу лекций
1 Организация контроля качества на пищевом предприятии
1.1 Лаборатория – контролирующий орган за качеством на предприятии
1.2 Организация контроля на предприятии: общие положения, правила отбора проб, входной контроль, контроль готовой продукции
2 Понятие о методах анализа сырья и продуктов питания
2.1 Объемные методы анализа. Титрование как метод количественного определения вещества: прямое, косвенное и обратное
3 Физические методы анализа
3.1 Методы гравиметрического (весового) анализа
3.2 Потенциометрические методы анализа
3.3 Кондуктометрические методы анализа
3.4 Рефрактометрические методы анализа
4 Колориметрические и спектрофотометрические методы анализа
4.1 Количественный колориметрический анализ. Принцип фотометрического определения веществ
4.2 Нефелометрия. Флуоресценция. Фотографический атомно-эмиссионный спектральный анализ. Атомно-абсорбционная спектроскопия
5 Поляриметрический и полярографический методы анализа
5.1 Поляриметрический метод анализа. Виды поляриметров
5.2 Полярографический методы анализа. Виды количественного полярографического метода: расчетный метод, калибровочного графика, стандартных растворов и метод добавок
6 Радиометрический метод анализа
6.1 Радиоактивность и активность веществ. Понятие «поглощенная и экспозиционная доза». Приборы для определения радиологического заражения пищевых продуктов и воздуха
7 Хроматографические методы анализа
7.1 Классификация хроматографических методов анализа
7.2 Адсорбционная хроматография
7.3 Распределительная хроматография: на бумаге, в тонком слое, газожидкостная и ионообменная
7.4 Проникающая и аффинная хроматография
Литература
Введение
Уровень промышленного развития страны характеризуется не только объемом производства и ассортиментом выпускаемой продукции, но также показателями ее качества.
Качество продукции регламентируется едиными требованиями, предъявляемыми к данному виду продукции на основе действующей нормативной и технической документации. Технические регламенты и стандарты, а также правила, нормы, рекомендации помогают осуществлению организационных, технологических, экономических и других мероприятий, направленных на повышение качества продукции.
В этой связи необходимо повысить уровень контроля продукции, перейдя от выборочного контроля качества материалов и продукции к сплошному. Если выборочный контроль может реализоваться на базе разрушающих испытаний ограниченного количества продукции, то сплошной возможен только на основе применения неразрушающих методов, т.е. методов, не нарушающих пригодности продукции к использованию. Методы неразрушающего контроля предусматривают выявление дефектов пищевой продукции без ее повреждения. Это достигается путем использования физических методов, связанных с воздействием на объект контроля различных веществ, физических полей, или же регистрацией этих полей, имитируемых самим контролируемым объектом, а также многими другими методами анализа.
В данном электронном учебном курсе лекций рассматриваются существующие методы анализа для контроля качества сырья и готовой продукции при ее производстве и реализации. В соответствии с программой дисциплины изложены химические, физико-химические и физические методы анализа сырья, полуфабрикатов и готовой продукции пищевой промышленности.
1 Организация контроля качества на пищевом предприятии
Проблема качества никогда не теряет своей актуальности, она, по существу, постоянна. В условиях рыночных отношений стабильная производственно-экономическая деятельность предприятий пищевой отрасли агропромышленного комплекса непосредственно связана с решением таких задач, как повышение качества выпускаемой продукции, организация контроля качества на основе использования современных достижений науки и техники, выбор рациональных путей использования сырья, снижение себестоимости.
Понятие «контроль качества на предприятии» охватывает следующие стороны контроля на предприятии, направленные на обеспечение выпуска продукции характеризованного качества:
- входной контроль сырья, компонентов, материалов;
- производственный контроль;
- приемочный контроль готовой продукции;
- микробиологический контроль сырья, компонентов, производства и готовой продукции;
- контроль тары и упаковки на предприятии;
- контроль санитарного состояния предприятия;
- метрологический контроль производства.
Контроль качества компонентов, материалов, сырья и готовой продукции возлагается на работников лаборатории.
(1) Аттестация лабораторий – комплексная проверка и оценка метрологического обеспечения и общего уровня проводимых лабораторией работ с учетом ее специфики.
(2) Метрологическая служба предприятия – структура, выполняющая организацию работ по метрологическому обеспечению на предприятии.
(3) Поверка средств измерений – это комплекс работ для установления их пригодности к применению.
(1) Выборка это определенное количество пищевых продуктов, отбираемое за один прием от каждой единицы упаковки ящика, клетки, бочки или штабеля неупакованной продукции, для составления исходного образца.
(2) Выборочный контроль – контроль не каждого из изготовленных изделий, а исследование определенным образом подготовленной пробы, состав которой должен отражать качество всей продукции в целом.
(3) Единичный показатель качества продукции это показатель, относящийся только к одному из ее свойств.
(4) Исходный образец – совокупность отдельных выборок, отобранных от однородной партии.
(5) Многоступенчатый и последовательный контроль – контроль, при котором решение о возможности отправки партии продукции принимают по результатам контроля одной или более выборок.
(6) Навеска – часть пробы, предназначенная для определения отдельных показателей качества пищевых продуктов.
(7) Однородная партия это определенное количество пищевых продуктов одного вида и сорта, в таре одного типа и размера, одной даты и смены выработки, изготовленное одним предприятием, предназначенное к одновременной сдаче, приемке, осмотру и качественной оценке.
(8) Одноступенчатый контроль – решение о приемке или забраковке партии принимают по результатам контроля только одной выборки или пробы.
(9) Преднамеренная выборка – выборка, организованная таким образом, чтобы была достигнута вероятность отбора дефектных образцов.
(10) Приемочный контроль – это проверка качества продукции, осуществляемая по окончании производственного процесса и при передаче продукции от поставщика к потребителю, либо по окончании отдельных этапов технологического процесса и при передаче полуфабриката одним производственным участком другому.
(11) Проба это часть среднего образца, подготовленная соответствующим образом для проведения лабораторных испытаний.
(12) Случайная выборка – выборка, при которой все изделия выборки будут иметь равные шансы попасть в число испытуемых.
(13) Сплошной приемочный контроль – контроль, при котором подвергается анализу каждое изготовленное изделие, применяется только тогда, когда он не приводит к утрате потребительских свойств контролируемой продукции.
(14) Средний образец это часть исходного образца, выделенная для проведения лабораторных испытаний.
1 Организация контроля качества на пищевом предприятии
1.1 Лаборатория – контролирующий орган за качеством на предприятии
На пищевом предприятии и в контролирующих качество продукции организациях весьма важная роль принадлежит лаборатории, поскольку она является контролирующим органом и основная ее задача обеспечение выпуска стандартной продукции высокого качества. В обязанности лаборатории входит:
- осуществление контроля за качеством сырья, полуфабрикатов и вспомогательных материалов, поступающих на предприятие, а также хранящихся на складах (входной контроль);
- проведение анализов на промежуточных стадиях производственного процесса для проверки правильности соблюдения технологических параметров, предупреждение брака готовой продукции (промежуточный контроль);
- контроль качества готовой продукции и установление соответствия показателям, нормируемым стандартами.
Функции лаборатории:
- проведение экспериментальных работ, направленных на повышение качества продукции и совершенствование методов контроля;
- изыскание путей снижения количества отходов и их рационального использования, участие во внедрении малоотходных и безотходных технологических схем;
- выявление причин допущенного брака и осуществление мероприятий по его сокращению;
- контроль качества питьевой воды, тары;
- контроль за санитарным состоянием производства, соблюдением правил личной гигиены всеми работающими на предприятии, за соблюдением инструкций по санитарно-техническому контролю;
Результаты контроля производства на всех его этапах фиксируются в соответствующих журналах. В журналах не допускаются помарки, исправления. Они должны быть прошнурованы, страницы пронумерованы; на последней странице ставится печать и подпись руководителя предприятия.
Приведем примеры применения и заполнения типовых форм по контролю производства пищевой продукции.
Форма К-1 «Журнал контроля качества поступающего сырья». На каждый вид сырья в журнале отводится отдельный лист. Журнал заполняется лаборантом.
Форма К-2 «Журнал контроля качества вспомогательных материалов и тары». Заполняется по результатам проверки качества каждой поступающей на предприятие партии вспомогательных материалов и тары (сахар, соль, специи, крупы, крышки, тара стеклянная и жестяная, полимерные материалы и др.) в соответствии с требованиями, изложенными в соответствующих стандартах. Журнал заполняется сотрудником, производившим анализ.
Форма К-11 «Лабораторный журнал контроля качества готовой продукции». Заполняется по результатам технических, физико-химических исследований и органолептической оценки качества готовой продукции. Анализ готовой продукции производится по тем показателям, которые предусматриваются нормативно-техническими документами на исследуемые продукты. Используемые методы анализа должны быть стандартизованы. На каждый вид продукции отводится в журнале отдельный лист. Заполняется журнал старшим химиком или химиком-аналитиком.
Форма К-13 «Журнал дегустации». В журнал заносят результаты выборочной органолептической оценки всех видов продукции. Органолептическая оценка производится дегустационной комиссией под председательством директора или главного инженера предприятия. Состав дегустационной комиссии утверждается приказом по предприятию. После заполнения журнала соответствующую страницу подписывают все участвующие в дегустации. Журнал заполняется секретарем дегустационной комиссии.
Лабораторию, как правило, размещают в специально оборудованном помещении с изолированным входом и, по возможности, вблизи обслуживаемых ею цехов.
Температуру воздуха в лаборатории желательно поддерживать в пределах 18-20°С, что соответствует температуре, принятой для проведения большинства анализов.
Большое значение имеет оборудование лаборатории, наличие необходимой мебели, приборов, а также внешнее ее оформление. Мебель и оборудование должны размещаться удобно и рационально как с точки зрения удобства работы, так и с позиций требований техники безопасности.
Лаборатория должна иметь:
- аппараты для нагревания, выпаривания, перегонки и высушивания (испарители, электропечи, сушильные шкафы и термостаты, бани различных конструкций и др.);
- аппаратуру для ведения процессов при повышенных температурах (реакторы, автоклавы и др.);
- оборудование для дробления, измельчения, рассева и перемешивания (ступки, мельницы, сита лабораторные, мешалки, встряхивающие аппараты и др.);
- устройства для охлаждения веществ и материалов (бытовые холодильники, криостаты, сосуды Дьюара и др.);
- оборудование для создания вакуума и давления (механические и струйные вакуумные насосы, компрессоры и др.);
- оборудование для получения и применения газов;
- дистилляторы;
- источники электрического тока и его преобразования (батарея, трансформаторы и др.);
- источники света и оптические устройства.
Большинство работ, выполняемых в лаборатории, связано с использованием веществ, оказывающих вредное воздействие на организм человека, и сложного оборудования. Несоблюдение мер предосторожности и правил техники безопасности может привести к травмам, взрывам, пожару и пр.
При любых травмах после оказания первой помощи к пострадавшему следует немедленно вызвать врача или скорую помощь.
Сотрудники, работающие в химических лабораториях, должны получать специальное питание молоко. Профилактический ежедневный прием этих продуктов позволяет полностью исключить вредное влияние на организм химических веществ.
В каждом помещении, где проводятся химические или физико-химические исследования, должен быть ответственный за соблюдение правил техники безопасности.
В настоящее время Федеральное агентство по техническому регулированию и метрологии (Ростехрегулирование) установил общий порядок организации и проведения аттестации лабораторий (1). Аттестация представляет собой комплексную проверку и оценку метрологического обеспечения и общего уровня проводимых работ с учетом их специфики.
Аттестацию проводят ведомственные метрологические службы с участием представителей территориальных органов Ростехрегулирования с целью обеспечения единства и достоверности измерений химического состава и физико-химических свойств сырья, материалов, полуфабрикатов и готовой продукции промышленных предприятий. Задачей аттестации являются изучение, анализ, оценка и официальное подтверждение наличия в лаборатории необходимых условий для проведения всех работ, входящих в круг обязанностей данной лаборатории.
Существует два вида аттестации: первичная для всех действующих и вновь создаваемых лабораторий и периодическая проводимая не реже 1 раза в 5 лет.
При отрицательном результате аттестации службы Ростехрегулирования назначают срок повторной аттестации.
После проведения всех работ по аттестации лаборатории составляется акт, утверждаемый главным метрологом вышестоящей организации, ответственной за ее проведение. На основе акта выдается свидетельство о наличии в лаборатории необходимых условий для выполнения достоверного контроля качества продукции. В нем отмечается срок его действия.
Важной формой государственного надзора за измерительной техникой является поверка средств измерений (3), которая устанавливает их метрологическую пригодность. Обязательной государственной поверке подлежат средства измерения, применяемые при учете материальных ценностей, взаимных расчетах и в торговле, а также те средства измерений, использование которых связано с охраной здоровья трудящихся и техникой безопасности. Обязательной государственной поверке подлежат весоизмерительные приборы, расходомеры, счетчики электроэнергии, нефтепродуктов, воды, газа.
Аттестация испытательного оборудования проводится с целью определения нормированных характеристик по степени точности выдаваемых замеров и установления пригодности их к эксплуатации.
В функции метрологической службы предприятия (2) (объединения) входят организация поверки средств измерений, а также контроль за соблюдением правил их эксплуатации. От хорошей организации этой службы зависят результаты проводимых измерений, анализов, контроля производства.
1.2 Организация контроля на предприятии: общие положения, правила отбора проб, входной контроль, контроль готовой продукции
Лаборатория осуществляет контроль всех видов сырья и материалов, поступающих на предприятие. Различают входной контроль, приемочный, сплошной и выборочный, одноступенчатый, многоступенчатый и т.д.
Поступающее на предприятие сырье подвергается входному контролю. При этом определяется его качество, сортность, влажность, засоренность и другие показатели.
Затем последовательно осуществляется контроль по этапам и операциям всего технологического процесса.
Приемочный контроль (10) – это проверка качества продукции, осуществляемая по окончании производственного процесса и при передаче продукции от поставщика к потребителю, либо по окончании отдельных этапов технологического процесса и при передаче полуфабриката одним производственным участком другому. Способы приемочного контроля выбирают в зависимости от показателей, приводимых в нормативной и технической документации (ТР, ГОСТ, ГОСТ Р, ТУ). Сплошной приемочный контроль (13), при котором подвергается анализу каждое изготовленное изделие, применяется только тогда, когда он не приводит к утрате потребительских свойств контролируемой продукции.
Например: при исследовании продукции консервных заводов сплошной контроль невозможен, так как эти испытания являются разрушающими, он возможен только за качеством заполнения банок, их внешнего вида и укупорки.
О качестве готовой продукции, сырья и вспомогательных продуктов обычно судят по результатам выборочного контроля (2). Под выборочным контролем понимают контроль не каждого из изготовленных изделий, а исследование определенным образом подготовленной пробы, состав которой должен отражать качество всей продукции в целом.
Чтобы правильно понять, что собой представляет проба продукции, подготовленная к проведению анализа, необходимо расшифровать термины «однородная партия продукции», «выборка», «средний образец», «проба», «навеска» и т.д.
Однородная партия (7) это определенное количество пищевых продуктов одного вида и сорта, в таре одного типа и размера, одной даты и смены выработки, изготовленное одним предприятием, предназначенное к одновременной сдаче, приемке, осмотру и качественной оценке.
Выборка (1) это определенное количество пищевых продуктов, отбираемое за один прием от каждой единицы упаковки ящика, клетки, бочки или штабеля неупакованной продукции, для составления исходного образца.
Исходным образцом (4) называют совокупность отдельных выборок, отобранных от однородной партии.
Средний образец (14) это часть исходного образца, выделенная для проведения лабораторных испытаний.
Проба (11) это часть среднего образца, подготовленная соответствующим образом для проведения лабораторных испытаний.
Навеской (6) называется часть пробы, предназначенная для определения отдельных показателей качества пищевых продуктов.
При выборочном контроле процедура отбора образцов для испытаний зависит от того, какие показатели качества подвергаются проверке. Так, если хотят проверить безвредность продукта, т.е. контролируют микробиологические показатели, наличие токсических элементов, ядохимикатов, консервантов и пр., пробы для исследования отбираются с таким расчетом, чтобы выявить именно те образцы, которые могут оказаться недоброкачественными. В этом случае выборка является преднамеренной (9), т. е. организованной таким образом, чтобы была достигнута вероятность отбора дефектных образцов.
При контроле других показателей качества массовой доли сухих веществ, жира, кислотности и др. задача состоит в том, чтобы не допустить поступления к потребителю продукции, не отвечающей по качеству требованию стандарта. В соответствии с этим к отбираемой выборке предъявляется определенное требование она должна достаточно достоверно представлять партию продукции. Для однородной партии продукции выборка или проба тогда будет представлять партию, когда будет применен принцип случайного отбора образцов. При этом все изделия выборки будут иметь равные шансы попасть в число испытуемых. Такая выборка носит название случайной (12).
В зависимости от числа используемых выборок, представляемых для исследования, различают одноступенчатый, многоступенчатый и последовательный контроль.
При одноступенчатом контроле (8) решение о приемке или забраковке партии принимают по результатам контроля только одной выборки или пробы. Одноступенчатый контроль значительно проще других и обеспечивает оперативность получения требуемой информации о качестве продукции.
Многоступенчатый и последовательный контроль (5) довольно сложны в организации. Частный случай многоступенчатого контроля – двухступенчатый контроль, при котором решение о возможности отправки партии продукции принимают по результатам контроля одной или двух выборок. При последовательном контроле не оговаривается заранее число подлежащих отбору выборок, а необходимость отбора каждой последующей выборки зависит от результатов контроля предыдущих.
В пищевой промышленности используют обычно одноступенчатый или двухступенчатый вид контроля.
Правильный отбор пробы для проведения анализов наряду с правильным использованием принятого метода определения единичного показателя качества продукции (3) (единичный показатель качества продукции это показатель, относящийся только к одному из ее свойств – содержание хлорида натрия и т.д.) является одной из самых важных задач.
Состав подготовленной пробы должен отражать качество всей партии продукции в целом. Для составления исходного и среднего образцов необходимо брать из однородной партии продукции такое количество единиц упаковки (банок, ящиков, бочек и пр.), которое отражало бы качество всей партии. Решению этого вопроса помогают методы вариационной статистики. Практически число единиц продукции, отбираемой для приготовления исходного образца, устанавливается правилами приемки, изложенными в соответствующих стандартах.
Отбор проб продукции разной консистенций осуществляется различными предметами. Все пищевые продукты могут быть объединены в 6 групп:
- жидкие однородные материалы (пробы жидкостей отбирают специальными трубками-пробниками или насосом конструкции Бахтина (трубка с поршнем, шариковыми клапанами и сливным отводом));
- жидкие неоднородные материалы, способные расслаиваться и образовывать эмульсии (отбирают при разгрузке тары в начале, середине и конце слива или из разных слоев вскрытой единицы тары);
- материалы твердой мажущей консистенции, фасованные в крупную тару (пробы отбирают масляным щупом);
- сыпучие материалы (пробы отбирают специальным мешочным щупом из разных мест верхнего, среднего и нижнего слоев мешка);
- плоды, овощи, мелкая рыба, консервированные продукты (пробы отбирают, руководствуясь данными о количестве единиц упаковки в однородной партии);
- мясо в тушах и полутушах, крупная рыба, птица (отбирают от каждой исследуемой мясной туши и ее части целым куском массой не менее 200 г из определенных мест (у 3 тушек птицы скальпелем по 70г), для получения однородной пробы каждый образец отдельно пропускают через мясорубку с диаметром отверстии решетки 2 мм; фарш тщательно перемешивают).
Входной контроль осуществляет лаборант на сырьевой площадке. Целью входного контроля является установление доли стандартных и нестандартных плодов, видов порчи, а для некоторых продуктов (яблок, винограда) массовой доли сухих веществ.
Свежие овощи и плоды, поступающие в переработку, по качественному состоянию и упаковке должны соответствовать требованиям стандартов.
При проведении технического анализа свежих овощей и плодов принимают во внимание следующие признаки: форму, величину, окраску, степень зрелости, внутреннее строение плодов и овощей, наличие повреждений (механических, сельскохозяйственными вредителями и др.).
Порчу свежих плодов и овощей в начальной стадии можно обнаружить с помощью флуоресценции другими методами это установить практически невозможно.
Например: здоровый картофель на разрезе имеет желтую флуоресценцию, пораженный фитофторой голубую, с наличием кольцевой гнили зеленоватую, подмороженный – беловатую. Лимоны и апельсины имеют желтую флуоресценцию с голубоватым оттенком, мандарины – темно-оранжевую с фиолетовым оттенком.
При поражении плодов голубой плесенью появляется темно-синяя флуоресценция в виде пятен в местах поражения. Целесообразно организовать проверку на возможность поражения голубой плесенью плодов, имеющих механические повреждения, а также перезревших.
Качество мяса определяется его морфологическим и химическим составом, правильностью технологической обработки туш и свежестью.
Доброкачественное мясо должно быть хорошо обескровлено, не иметь сгустков крови, кровоподтеков, побитостей, поврежденных тканей, остатков внутренних органов и загрязнений содержимым желудочно-кишечного тракта. Степень свежести мяса определяется органолептическими, а также химическими и бактериологическими методами.
Качество живой рыбы характеризуется ее общим состоянием, упитанностью и размерами. Живая рыба должна быть здоровой, упитанной, с естественной блестящей окраской, без наружных повреждений и видимых признаков заболеваний.
Охлажденная рыба должна иметь естественную окраску, чистые кожные покровы без повреждений, жабры от темно-красного до розового цвета, покрытые тягучей прозрачной слизью; запах свежий, без порочащих примесей.
Мороженая рыба должна быть без каких-либо дефектов.
Свежесть рыбы может быть оценена по степени ее люминесценции:
- при сомнительной свежести появляется ярко-белое свечение с голубоватым оттенком;
- несвежая рыба дает коричневатое свечение с оранжевыми или красными пятнами.
Растительные масла в зависимости от степени очистки подразделяют на: нерафинированные; гидратированные; рафинированные и дезодорированные.
К показателям, характеризующим видовые признаки и товарные качества (свежесть, примеси других масел), относят запах, вкус, цвет, прозрачность, отстой, плотность, коэффициент преломления, кислотное и йодное числа, число омыления, наличие неомыляемых веществ.
Сахар-песок выпускают трех видов:
- мелкокристаллический (должен быть сыпучим, сухим на ощупь без посторонних примесей и комков, белого цвета с блеском, вкуссахара и его растворов сладкий, без постороннего привкуса и запаха, он должен растворяться полностью, образуя прозрачный раствор);
- рафинированный (крупные кристаллы с хорошо выраженными гранями и плоскостями);
- для промышленной переработки.
Пряности. Основное внимание следует уделять контролю условий хранения пряностей. Хранят их в плотной упаковке, не пропускающей влаги и воздуха. Их нельзя держать в помещении, где находятся другие продукты с резким или специфическим запахом. Негерметично упакованные пряности также могут передавать свой запах другим продуктам.
Поваренная соль бывает трех сортов: «Экстра» (99,7% – массовая доля хлор-иона в пересчете на сухое вещество, % не менее), высший (98,4%), первый (97,7%).
Пищевая соль должна иметь определенный для каждого сорта размер зерен, а также влажность. Химический состав всех видов пищевой соли должен быть одинаковым, причем количество примесей в пересчете на сухое вещество не должно превышать 2,5%.
Контроль качества готовой продукции проводят по комплексу физико-химических, микробиологических и органолептических показателей. В зависимости от вида выпускаемой продукции перечень контролируемых показателей различен и оговорен соответствующими стандартами.
Микробиологические исследования проводятся с целью обнаружения возбудителей пищевых отравлений и инфекционных заболеваний, а также вызывающих различные виды порчи.
Органолептической оценке подлежат все виды готовой продукции по правилам, заложенным в стандартах на исследуемые изделия.
Комплекс физико-химических показателей, подлежащих контролю, различен для разных групп пищевых продуктов: содержание влаги, величина рН, массовая доля сухих веществ, жира, хлоридов (NaCI), кислотность, массовая доля минеральных примесей, кислот, общего сахара, спирта, мякоти, наличие посторонних примесей и токсичных элементов (тяжелых металлов).
Таким образом, качество продуктов питания тесно связано с проблемой контроля. Качество сырья и готовой продукции должно соответствовать требованиям нормативной и технической документации, где изложены все технические требования к качеству сырья, правила его приемки, методы испытания, а также условия хранения, гарантии предприятия-изготовителя.
Стандартизованные методы контроля качества готовых продуктов постоянно совершенствуются, заменяются более точными и универсальными, современными. Работники лабораторий должны систематически пополнять свои знания в этой области.
1. Какова роль методов анализа в процессе получения высококачественной пищевой продукции?
2. Каковы обязанности и функции производственной лаборатории?
3. Где фиксируются результаты производственного контроля качества сырья и пищевых продуктов? Приведите примеры.
4. Каковы требования к оборудованию, использующегося в лаборатории?
5. Техника безопасности работников производственной лаборатории.
6. Что такое аттестация и аккредитация лабораторий?
7. Что такое поверка средств измерений?
8. Кто является ответственным за аттестацию лабораторного оборудования?
9. Что такое входной контроль, каковы его виды?
10. Чем отличается случайная выборка от преднамеренной?
11. В чем недостаток сплошного производственного контроля?
12. Какой чаще всего применяется контроль качества сырья и готовой продукции (одноступенчатый или многоступенчатый)?
13. Что включает в себя контроль качества готовой продукции?
14. Как правильно отбираются пробы пищевых продуктов для анализа?
15. В чем особенность проведения входного контроля различных видов пищевых групп продукции на сырьевой площадке?
2 Понятие о методах анализа сырья и продуктов питания
В России проблемы качества и все вопросы, связанные с созданием общегосударственной системы управления качеством, сегодня приобретают чрезвычайную актуальность. Экономическое возрождение России немыслимо без создания условий, обеспечивающих высокое качество и безопасность отечественных товаров, повышение их конкурентоспособности, защиту прав потребителей на внутреннем и мировом рынках. В связи с этим творческое усвоение теоретических и практических знаний специалистами в области изучения и использования методов анализа сырья и пищевых продуктов и проведения экспертизы качества является актуальной задачей, так как недооценка значения качества продукции и необходимости систематической и целенаправленной работы по его повышению приводит к потере позиций российской промышленности во многих ключевых отраслях. В решении этой задачи непосредственное участие должны принимать все предприятия и организации, специалисты промышленности, сельского хозяйства и торговли, работающие в сфере производства и реализации потребительских товаров.
Среди эффективных средств для выполнения поставленной задачи важное место занимает экспертиза качества товаров. Цель такой экспертизы – на основе тщательного анализа качества товаров определить их потребительскую ценность, т. е. социальную эффективность, полезность, удобство пользования и эстетическое совершенство, что реализуется при использовании современных методов анализа. Будучи элементом системы управления качеством товаров, экспертиза призвана стать барьером на пути к потребителю некачественных, неконкурентоспособных товаров, а также к производству и реализации опасной продукции. Всему этому способствует современные методы анализа сырья и пищевых продуктов.
(1) Косвенное титрование, или титрование заместителя – титрование, которое применяют, когда нет подходящей реакции или индикатора для прямого титрования. В этом случае используют реакцию, в которой анализируемое вещество замещают эквивалентным количеством другого вещества и затем титруют рабочим раствором.
(2) Метод объемного (титрометрического) анализа - это метод количественного определения, основанный на измерении объема реагента, требуемого для проведения реакции с определяемым веществом.
(3) Обратное титрование – титрование, которое используют в тех случаях, когда прямое титрование невозможно или когда анализируемое вещество неустойчиво. При этом берут два рабочих раствора, один из которых добавляют в избытке, а вторым титруют избыток первого.
(4) Прямое титрование наиболее распространенный и удобный прием, когда к анализируемому раствору вещества непосредственно добавляют рабочий раствор известной концентрации.
(5) Титрование –процесс постепенного добавления раствора точно известной концентрации к исследуемому раствору.
(6) Точка эквивалентности – установление конечной точки титрования.
2.1 Объемные методы анализа. Титрование как метод количественного определения вещества: прямое, косвенное и обратное
Метод объемного (титрометрического) анализа (2) это метод количественного определения, основанный на измерении объема реагента, требуемого для проведения реакции с определяемым веществом.
Объемные методы анализа основаны на протекании реакций нейтрализации, осаждения, ионного обмена, комплексообразования, окисления-восстановления и др. Они должны удовлетворять следующим условиям:
- строгое соблюдение стехиометрических соотношений между веществами реакций;
- быстрое и количественное протекание реакций;
- точное и строгое фиксирование точки эквивалентности;
- посторонние вещества в анализируемой пробе не должны вступать в реакцию с добавляемым реагентом, что может помешать титрованию.
Титрованием (5) называют процесс постепенного добавления раствора точно известной концентрации к исследуемому раствору.
Одной из основных стадий этого процесса, во многом определяющей точность объемного метода, является установление конечной точки титрования, называемой точкой эквивалентности (6). Точку эквивалентности определяют визуально по изменению цвета раствора, индикатора, появлению помутнения либо инструментальными методами кондуктометрическое, потенциометрическое титрование.
Для титрования достаточно 1-3 капель раствора индикатора массовой долей 0,1-0,5 % на 10-100 см3 анализируемого раствора.
Титрометрическое определение осуществляют прямым, косвенным и обратным титрованием.
Прямое титрование (4) наиболее распространенный и удобный прием, когда к анализируемому раствору вещества непосредственно добавляют рабочий раствор известной концентрации.
Косвенное титрование, или титрование заместителя (1), применяют, когда нет подходящей реакции или индикатора для прямого титрования. В этом случае используют реакцию, в которой анализируемое вещество замещают эквивалентным количеством другого вещества и затем титруют рабочим раствором.
Обратное титрование (3) используют в тех случаях, когда прямое титрование невозможно или когда анализируемое вещество неустойчиво. При этом берут два рабочих раствора, один из которых добавляют в избытке, а вторым титруют избыток первого.
Расчет массовой доли определяемого вещества Х (в %) через массовую концентрацию рабочего раствора ведут по формуле
Х=100 VСМ /(1000т), (2.1)
где V - объем рабочего раствора, пошедшего на титрование, см3;
С - молярная концентрация рабочего раствора, моль/дм3;
М - молекулярная эквивалентная масса определяемого вещества, г/моль;
m - масса навески анализируемого вещества, г.
1. На чем основан метод объемного анализа?
2. Какие виды титрования применяются при объемном методе анализа?
3 Физические методы анализа
Область применения физических методов в практике пищевых производств обширна и охватывает измерение массы, плотности, вязкости, электропроводности, концентрации водородных ионов, коэффициента рефракции.
(1) Вискозиметры – приборы для определения вязкости.
(2) Кинематическая вязкость – отношение динамической вязкости к плотности жидкости.
(3) Метод гравиметрического, или весового,анализа – метод количественного анализа, основанный на точном измерении массы определяемого вещества, выделенного в виде неорганических или органических соединений.
(1) Потенциометрический анализ – метод, который применяется для непосредственного определения активности ионов, находящихся в растворе (ионометрия), а также для индикации точки эквивалентности при титровании (потенциометрическое титрование).
(1) Кондуктометрическое титрование – титрование, при котором фиксируется скачкообразное изменение электропроводности в эквивалентной точке.
(2) Хронокондуктометрическое титрование – титрование, при котором рабочий титрованный раствор равномерно подается в сосуд для титрования и регистрируется зависимость: электрическая проводимость–время.
(1) Интерференция света – это наложение световых пучков, при котором они в одних местах гасят друг друга, а в других усиливают.
(2) Рефракцияили явление лучепреломления – процесс, который наблюдается при переходе лучей из одной среды в другую, причем скорость распространения света в них различна.
3.1 Методы гравиметрического (весового) анализа
Метод количественного анализа, основанный на точном измерении массы определяемого вещества, выделенного в виде неорганических или органических соединений, получил название гравиметрического, или весового,анализа (3).
По способу определения различают методы выделения, методы осаждения и методы отгонки.
В первом случае определяемый компонент количественно выделяют в свободном состоянии и взвешивают на аналитических весах.
В качестве примера можно привести определение массовой доли золы в пищевых продуктах, основанное на сжигании и последующем прокаливании до постоянной массы навески в предварительно взвешенном тигле. Оставшееся в тигле содержимое взвешивают и по его массе вычисляют процентное содержание золы в пищевом продукте.
В методах осаждения определяемый компонент выделяется с помощью химических реактивов в виде малорастворимых осадков определенного химического состава. Осадок промывают, высушивают до постоянной массы и взвешивают. Так определяют SО4--, Cl- и другие ионы в пищевых продуктах.
В последнем случае определяемый компонент отгоняется из анализируемой пробы в виде легколетучего соединения.
Данным способом устанавливают массовую долю влаги в пищевых продуктов, наличие в них СО2, NН3 и других летучих веществ.
Все модификации весового метода отличает большая точность, что позволяет их применять в арбитражных анализах. Недостатком же является большая продолжительность.
Результаты весового анализа, прежде всего, зависят от точности весов,их своевременной регулировки, погрешности разновесов.
В настоящее время в лабораторной практике широко используются аналитические весы модели АДВ-200 (аналитические демпферные воздушного торможения с предельной нагрузкой 200 г), ВЛК-500г-М (лабораторные квадрантные с предельной нагрузкой 500 г, без механизма компенсации тары) и ВЛКТ-500 г (с механизмом компенсации тары), весы лабораторные равноплечие 2 класса модели ВЛР-200 г и весы лабораторные равноплечие 3 класса модели ВЛР-1кг, а также многие виды весов электронного типа импортного и отечественного производства. Все лабораторные весы питаются от сети переменного тока через выносной понижающий трансформатор.
При работе с весами необходимо помнить, что если относительная погрешность взвешивания соизмерима с допустимой погрешностью гравиметрического анализа, то необходимо вводить поправку на неравноплечность весов. Масса навески анализируемой пробы должна быть подобрана так, чтобы массу взвешиваемого осадка можно было определить на аналитических весах с погрешностью, не превышающей допустимого значения.
Измерение плотности жидкости с помощью ареометра основано на определении силы выталкивания, действующей на погруженное в нее тело. По объему вытесненной жидкости и массе плавающего в ней ареометра определяется плотность исследуемой жидкости. На практике применяются ареометры постоянной массы и ареометры постоянного объема. Если шкала ареометра постоянной массы проградуирована в единицах плотности, то он называется денсиметром. Денсиметры для контроля плотности конкретных жидких сред носят название сахариметров, лактометров, спиртометров и т. п.
Вязкость является физическим свойством жидкости, проявляющимся при относительном движении соседних слоев. Измерение вязкости сводится к определению коэффициента вязкости с помощью закона Пуазейля для ламинарного течения по капиллярам:
Отношение динамической вязкости к плотности жидкости называется кинематической вязкостью (2).
Приборы для определения вязкости называются вискозиметрами (1). В лабораториях заводов наиболее часто используется вискозиметр Оствальда (рис. 3.1).

Рисунок 3.1 Вискозиметр Оствальда
Порядок работы и принцип действия вискозиметров описаны в инструкциях по эксплуатации и в справочных руководствах, где даны также таблицы для учета влияния температуры и концентрации веществ на вязкость различных пищевых продуктов.
3.2 Потенциометрические методы анализа
Для непосредственного определения активности ионов, находящихся в растворе (ионометрия), а также для индикации точки эквивалентности при титровании (потенциометрическое титрование) широко применяется потенциометрический анализ (1).
Техника прямой потенциометрии следующая: два электрода из различных металлов погружают в раствор, содержащий вещества, не реагирующие с ними, и между этими электродами возникнет разность потенциалов. Разность потенциалов Е, возникающая между электродами, в общем описывается уравнением
Е = E- k lg (АА+АВ-) +k lg (АА+АВ-), (3.1)
где E - стандартный потенциал (величина, постоянная при данной температуре);
k = RT ln 10 / (nF),
где R – удельная газовая постоянная, кДж/(кг*К);
T - абсолютная температура, оС;
n- число электронов, принимаемое или отдаваемое одной молекулой определяемого вещества;
F - число Фарадея, Кл/моль.
При измерении электродвижущей силы (ЭДС) необходим электрод сравнения. Наиболее распространен в потенциометрии хлорсеребряный электрод сравнения (Ag, AgCl/KCl).
Применяются также каломельный и сурьмяный электроды. Для прямой потенциометрии (ионометрии) используют стеклянные электроды, электроды с гомогенной или гетерогенной мембраной, жидкостные, газовые электроды и ферментные.
Широкое распространение в лабораторной и заводской практике пищевых производств получил стеклянный электрод, предназначенный для измерения рН (рис. 3.2). Потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле, с ионами водорода из раствора. Диапазон измерения рН зависит от типа применяемого стеклянного электрода.
Более подробно рекомендации по определению рН в различных средах содержатся в руководствах по эксплуатации рН-метров.
В последние годы разработаны ионоселективные электроды, чувствительные к определенным катионам и анионам. Селективная мембрана в них может быть выполнена из твердых (например, стекло), жидких (органический ионообменный или нейтральный макроциклический комплексообразователь) материалов, содержать в себе иммобилизованные ферменты или микроорганизмы.
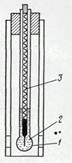
Рисунок 3.2 - Стеклянный мембранный электрод:
1 - стеклянная мембрана;
2 - внутренний раствор;
3 - внутренний электрод сравнения Ag/AgCl
Электроды двух последних типов позволяют определять концентрацию сложных органических соединений, не диссоциирующих на ионы, – витаминов, гормонов, антибиотиков.
Для проведения аналитических работ можно пользоваться отечественными рН-метрами типа рН-121, рН-125, рН-150, иономером ЭВ-74, а также зарубежных фирм Radiometr (Дания), Orion (США) и др.
При потенциометрическом титровании могут использоваться реакции кислотно-основного взаимодействия, окисления-восстановления, реакции осаждения и комплексообразования, в ходе которых изменяется концентрация потенциалопределяющих ионов.
Потенциометрическое титрование основано на определении точки эквивалентности по рН. Вблизи точки эквивалентности происходит резкое изменение потенциала электрода (рис. 3.3).
Установка для проведения потенциометрического титрования приведена на рис. 3.4
Основными достоинствами рассматриваемого метода являются высокая точность, чувствительность и возможность проводить определения в более разбавленной среде, чем это позволяют визуальные индикаторные методы.
Кроме того, этим методом можно определять несколько веществ без предварительного разделения, а также исследовать мутные и окрашенные растворы. Возможна полная или частичная его автоматизация за счет подачи рабочего раствора, записи кривой титрования, отключения подачи титранта в заданный момент титрования, соответствующий точке эквивалентности.

Рисунок 3.3 - Кривые потенциометрического титрования кислоты щелочью: а – интегральная; б – дифференциальная

Рисунок 3.4 Установка для потенциометрического титрования:
1 - магнитная машина; 2 - исследуемый раствор; 3 - хролсеребряный электрод (электрод сравнения); 4 - индикаторный электрод; 5 - бюретка; 6 – потенциометр.
В настоящее время промышленность выпускает несколько типов автотитраторов (один из них БАТ-115).
3.3 Кондуктометрические методы анализа
Для возможности автоматического контроля качества пищевых продуктов исследуют электрическую проводимость веществ в различных растворителях с помощью кондуктометрического метода анализа.
Кондуктометрический метод имеет две модификации:
1. В первой используется зависимость электропроводности раствора от его концентрации для определения количественного содержания растворенного вещества. На таком принципе работают различные промышленные концентратометры.
2. Во второй модификации данные измерений электропроводности служат для контроля химических процессов, протекающих в системе.
За единицу электрической проводимости принят Сименс (См), а электрическая проводимость раствора выражается в единицах удельной h (См.м-1) или эквивалентной q (См.м2.кг.экв-1) электрической проводимости. Удельная и эквивалентная проводимости связаны соотношением:
q = h/С, (3.2)
где С – молярная концентрация раствора, кг-моль/м3.
В разбавленных растворах сильных электролитов зависимость электропроводности от концентрации выражается уравнением:
q = q0 – A  , (3.3)
, (3.3)
где q – эквивалентная электропроводность, См.м2.кг.экв-1;
q0 – эквивалентная электропроводность при бесконечном разбавлении, См.м2.кг.экв-1;
А – постоянная величина.
Кондуктометрический метод используется в технохимическом контроле в вариантах прямой кондуктометрии и кондуктометрического титрования.
Точность кондуктометрических измерений позволяет применять их в автоматизированных средствах контроля качества пищевых продуктов и управления технологическими процессами в молочной, мясной, масложировой и других отраслях пищевой промышленности.
Разновидностью кондуктометрии является титрование, при котором фиксируется скачкообразное изменение электропроводности в эквивалентной точке.
При кондуктометрическом титровании (1) могут быть использованы реакции осаждения, нейтрализации, комплексообразования и др., в ходе которых достаточно заметно изменяется электрическая проводимость растворов после достижения точки эквивалентности. Точка эквивалентности в данном случае находится графическим методом (рис. 3.5).

Рисунок 3.5 – Кривые кондуктометрического титрования соли, сильной и слабой кислот сильным основанием: 1 – соль; 2 – сильная кислота; 3 – слабая кислота.
При проведении кондуктометрического титрования для получения резкого излома на кривых титрования необходимо учитывать эффект разбавления. Последний можно свести к минимуму, титруя большой объем разбавленного раствора в кондуктометрической ячейке концентрированным рабочим раствором.
Кондуктометрические измерения проводятся при постоянном или переменном токе с использованием мостовых или компенсационных измерительных схем. Отечественная промышленность для этих целей выпускает реохордные мосты Р-38, Р-556, Р-577, а также кондуктометры типа «Импульс», АК-298 и др.
Другой разновидностью кондуктометрии является хронокондуктометрическое титрование (2), когда рабочий титрованный раствор равномерно подается в сосуд для титрования и регистрируется зависимость: электрическая проводимость–время. При этом на кривых появляются четкие изломы, показывающие точки эквивалентности. Этот метод заложен в конструкции промышленных автотитраторов типа БАТ-115.
3.4 Рефрактометрические методы анализа
Для контроля за различными технологическими процессами в пищевой промышленности и за качеством пищевых продуктов широкое применение нашли рефрактометрические методы анализа.
Рефракция (2)или явление лучепреломления наблюдается при переходе лучей из одной среды в другую, причем скорость распространения света в них различна.
Относительный коэффициент или показатель преломления света однородной среды п определяют как отношение скорости света в вакууме к скорости света в данной среде. Сравнительной средой вместо вакуума может служить воздух, который в нормальных условиях имеет относительный коэффициент преломления света при длине волны 589,3 нм (линия D), равный 1,00027. Линией D служит желтый луч натриевого пламени. Величина п зависит от длины волны и температуры, поэтому измерения ее проводят в монохроматическом свете при постоянной температуре, указывая индексом при п принятое буквенное обозначение спектральной линии, в свете которой проводилось измерение, или длину волны, а показателем – температуру, например пD 20. Большей частью п измеряют в видимых лучах света.
Для практических измерений используют явление преломления света, падающего под углом a к нормали на границе двух сред и преломляющегося под углом b:
п= sin a / sin b. (3.4)
Измерение показателя преломления дает возможность непосредственно установить концентрацию двухкомпонентных растворов. Для этого используются эмпирические расчетные формулы и графики, так как теоретический расчет показателей преломления растворов с требуемой степенью точности в настоящее время невозможен.
Установлена зависимость между относительным коэффициентом преломления раствора и концентрацией растворенных в нем веществ. Для измерения относительного коэффициента преломления служат рефрактометры.
Наиболее простыми и самыми распространенными прибором для измерения с точностью до 1.10-3 являются рефрактометры с призмой Аббе. Измерительная призма Аббе снабжена откидывающейся на шарнире призмой, матовая грань которой служит для рассеивания лучей. Между призмами остается зазор 0,1 мм, который заполняется 1-2 каплями жидкости. Ход лучей в призме Аббе показан на рис. 3.6.
Рефрактометры снабжены компенсатором, позволяющим проводить измерение при освещении призм дневным или электрическим светом. Компенсатор отрегулирован так, что п отсчитывается для линии D натрия.
Рефрактометры часто имеют две шкалы: на одной – показатель преломления, на другой – содержание сухих веществ.

Рисунок 3.6 – Ход лучей в призме Аббе: 1 – преломляющая призма; 2 – осветительная призма
Интерференция света (1) – это наложение световых пучков, при котором они в одних местах гасят друг друга, а в других усиливают. Если один пучок света проходит в среде с показателем преломления п1 геометрический путь l1, а в другой среде с показателем преломления п2 путь l2, то разность хода равна
п1 l1 - п2 l2 = ml, (3.5)
где l – длина волны света;
т – величина, определяющая результат интерференции и называющаяся порядком интерференции.
Если т – целое число, то световые волны усиливают друг друга и получаются максимумы интенсивности. При разности хода, составляющей нечетное число полуволн, наблюдается взаимное гашение волн, и получаются минимумы интенсивности, а в результате – светлые и темные полосы.
Для измерений, связанных с интерференцией света, применяются приборы, называемые интерферометрами (рис. 3.7).
С помощью интерферометра нельзя измерять абсолютные значения показателей преломления, как в рефрактометре, а можно только сравнивать их для двух прозрачныхсред, например показатели преломления раствора и чистого растворителя. Интерферометры используют в пищевой промышленности при определении активности ферментных препаратов.
В левую кювету интерферометра наливают жидкость с более высоким показателем преломления, в правую – с более низким. При прохождении света через кюветы между лучами, идущими от разных щелей, образуется оптическая разность хода, которая приводит к сдвигу интерференционной картины в сторону от средней между щелями точки. В верхней части картина не меняется, нижняя же система полос дифракции меняется – они и служат индикатором. Именно относительно индикатора и наблюдается смещение верхней системы полос.

Рисунок 3.7 – Интерферометр: 1 – кожух; 2 – станина; 3 – подставка для кювет; 4 – оптическая система прибора; 5 – гнездо для установки кювет; 6 – мешалка.
Измеряя величину смещения интерференционных полос, определяют разность показателей преломления растворов.
Чувствительность прибора и точность измерения находятся в прямой зависимости от длины кюветы: чем длиннее кювета, тем выше точность измерения. С другой стороны, увеличение длины кюветы уменьшает интервал значений разности преломления n, которое можно измерить в этом случае. Предельные значения для кювет с различной толщиной слоя указываются в инструкции по эксплуатации прибора.
1. На чем основан метод весового анализа?
2. На чем основаны методы выделения, осаждения и отгонки?
3. Что лежит в основе измерения вязкости пищевых продуктов?
4. На чем основан метод измерения плотности жидкости?
5. Как называются приборы для измерения вязкости продуктов?
6. Что такое кинематическая и динамическая вязкость?
7. На чем основан потенциометрический метод анализа?
8. Виды потенциометрического метода анализа.
9. Какие виды электродов применяются при потенциометрическом титровании и ионометрии?
10. Что такое точка эквивалентности при потенциометрическом титровании?
11. Какие приборы используются в потенциометрии?
12. На чем основан метод кондуктометрического анализа?
13. Виды модификации кондуктометрии.
14. Что такое удельная и эквивалентная удельная проводимость?
15. Какие реакции используются при кондуктометрическом титровании?
16. Что такое хронокондуктометрическое титрование?
17. Какие приборы используются в кондуктометрии?
18. На чем основан рефрактометрический метод анализа?
19. Что такое рефракция и интерференция?
20. Принцип прохождения лучей в призме Аббе.
21. На чем основана работа рефрактометра и интерферометра?
22. Достоинства и недостатки рефрактометрического метода анализа.
4 Колориметрические и спектрофотометрические методы анализа
Колориметрические и спектрофотометрические методы включают в себя колориметрию и фотоколориметрию, фотометрию и спектрофотометрию в видимой, ультрафиолетовой и инфракрасной областях спектра. Для получения качественной характеристики замеряют спектр поглощения при различных длинах волн.
(1) Нефелометрия – метод анализа, основанный на измерении ослабления светового потока, проходящего через мутную пробу и предназначенный для анализа эмульсий, различных взвесей и других мутных сред.
(2) Стилометр – спектроскоп, предназначенный для спектрального анализа по спектрам испускания.
(3) Стилоскоп – спектроскоп, предназначенный для эмиссионного анализа.
(4) Флуоресценция, эмиссия – явление, при котором наблюдается возбуждение электронных спектров и ответное выделение квантов энергии молекулами при воздействии на молекулы каким-либо видом энергии (пламя, искра, плазма, ультрафиолетовое излучение)
(5) Фотографический атомно-эмиссионный спектральный анализ – метод, основанный на получении эмиссионных спектров анализируемого вещества на фотографической пластине.
4.1 Количественный колориметрический анализ. Принцип фотометрического определения веществ
В основе количественного колориметрического анализа лежит основной закон светопоглощения – закон Бегера-Ламберта-Бера:
D l = el l C, (4.1)
где D l – оптическая плотность вещества при длине волны;
el – коэффициент экстикции поглощающего вещества при длине волны l;
l – толщина слоя образца, см;
C – концентрация вещества, г/см3.
Основными параметрами всех фотометрических определений являются длина волны l, при которой производится измерение оптической плотности, величина оптической плотности D l толщина слоя образца l, концентрация раствора С.
Данный метод можно использовать для анализа только оптически прозрачных жидких сред.
Применение калибровочных графиков в соответствии с законом Бегера-Ламберта-Бера в координатах «оптическая плотность–концентрация» (рис. 4.1) является наиболее распространенным методом для количественных фотометрических измерений. Калибровочный график должен иметь вид прямой линии, которая проходит через начало координат.

Рисунок 4.1 – График зависимости оптической плотности от концентрации исследуемого раствора (калибровочный).
При анализе растворов сложного состава применяется метод добавок, позволяющий учитывать влияние «третьих» компонентов. Сущность его заключается в том, что сначала определяется оптическая плотность Dx анализируемого раствора, содержащего искомый компонент неизвестной концентрации Сх. Затем в этот раствор добавляется известное количество определяемого компонента Са и вновь измеряется D х+а.
В заводских и научно-исследовательских лабораториях для контроляразличных технологических процессов всех отраслей пищевой промышленности, оценки качества растительного и животногосырья, разнообразных пищевых продуктов широко используются простые, быстрые и точные фотометрические методы анализа, которые при сравнительно несложном оборудовании позволяют определять концентрацию анализируемых окрашенных растворов. Анализ окрашенных, а также бесцветных растворов можно проводить спектрофотометрическими методами, используя при этом более сложные приборы – спектрофотометры.
Измерение пропускания и оптической плотности растворов в области длин волн l=315-980 нм и определение концентрации веществ в растворе производят с помощью фотоэлектрических колориметров.
Современный отечественный фотоколориметр КФК-2 показан на рис. 4.2.
В качестве регистрирующего прибора в нем используется микроамперметр типа Н-907, градуированный в микроамперах по шкале 0-100 делений, соответствующей шкале светопропускания Т.
Принцип измерения коэффициента светопропускания состоит в том, что на фотоприемник направляются поочередно световые потоки: полный f0 l и прошедший через анализируемую среду f l и определяется отношение этих потоков по формуле
T = fl / f0l × 100. (4.2)

Рисунок 4.2 – Фотоколориметр КФК-2:
1 – микроамперметр; 2 – рукоятка настройки прибора на 100%-ное пропускание; 3 – рукоятка «чувствительности» (ввод фотоприемников в световой поток); 4 –рукоятка перемещения кювет с раствором сравнения и исследуемым раствором; 5 – рукоятка ввода цветных светофильтров; 6 – осветитель
Оптическая плотность D определяется по формуле
D = - lg fl / f0l = - lg T/100 = 2 – lg T. (4.3)
В научно-исследовательской практике используют и многоцелевой однолучевой фотометр Specol-10 фирмы Carl Zeiss Iena (Германия), который позволяет производить измерения светопропускания и оптической плотности при l=340-850 нм.
В качестве спектрофотометров в лабораториях пищевых продуктов используются отечественные приборы СФ-16, СФ-26, СФ-46. Однолучевые спектрофотометры этого типа предназначены для измерения светопропускания и оптической плотности растворов и твердых веществ при l=186-1100 нм.
В спектрофотометр помещена кювета, которая является составной частью его оптической схемы. Загрязненияна стенках кюветы и царапины сильно рассеивают и поглощают свет, искажая тем самым результаты измерений, поэтому обращаться с ней надоочень аккуратно. Содержимое кюветы должно быть гомогенные.
В практике пищевой промышленности широко используются отечественные пламенные фотометры типа ФПЛ, ПАМ, ПФМ и др. Наиболее широкое распространение в аналитической практике получили пламенные фотометры с интерференционными светофильтрами. В ряде случаев эти приборы снабжены микропроцессорами, что позволяет ускорить и автоматизировать выполнение анализа. Состав газовых сред указан в таблице 4.1.
Таблица 4.1 – Состав газовых сред
| Смесь | Температура, оС | Определяемые элементы |
| Воздух/природный газ | Na, K, Ca | |
| Воздух/пропан | Ca | |
| Воздух/ацетилен | Ca, Mg, Fe | |
| Окись азота/ацетилен | Ti, V |
Пламенные фотометры позволяют определять несколько элементов (последовательно) – натрий, калий, кальций, литий, а одноканальные многоэлементные фотометры с прямым отсчетом – до 11 элементов.
Многие задачи анализа многокомпонентных пищевых продуктов успешно решаются с помощью двухканальных пламенных фотометров типа Flapho фирмы Carl Zeiss, имеющих призму или дифракционную решетку и фотоумножитель в качестве детектора, что позволяет определять одновременно два элемента по абсолютному сигналу.
4.2 Нефелометрия. Флуоресценция. Фотографический атомно-эмиссионный спектральный анализ. Атомно-абсорбционная спектроскопия
Для анализа эмульсий, различных взвесей и других мутных сред используется нефелометрия (1). Метод основан на измерении ослабления светового потока, проходящего через мутную пробу.
Одним из основных принципов нефелометрических измерений является наличие эталонов мутности.
Для осуществления нефелометрических методов анализа ионы анализируемого элемента или органического соединения переводят в малорастворимое соединение, способное образовывать относительно устойчивую дисперсную систему в начальный период формирования осадка. Для этих целей удобны наименее растворимые в воде осадки, содержащие ионы Ва2+, Са2+ Ag+, Cl-, SО42-, СгО42- и др.
Нефелометрические определения проводят с помощью фотоэлектрических колориметров-нефелометров типа ФЭК-Н, ФЭК-56М и др.
При воздействии на молекулы каким-либо видом энергии (пламя, искра, плазма, ультрафиолетовое излучение) наблюдается возбуждение электронных спектров и ответное выделение квантов энергии молекулами – флуоресценция, эмиссия (4). Интенсивность флуоресценции пропорциональна концентрации соответствующего вещества.
Флуоресценция свойственна в основном органическим соединениям, поэтому в анализе неорганических веществ используют флуорогенные органические аналитические реагенты, образующие флуоресцирующие комплексы с минеральными соединениями. Высокая интенсивность флуоресценции объясняет низкий предел обнаружения, составляющий 10-8%.
Метод весьма чувствителен, и его используют для определения очень малых количеств веществ при анализе органических соединений, например витаминов, гормонов, антибиотиков и др.
Чаще других используется отечественный прибор марки ЭФ-4М с набором светофильтров для различных веществ.
Метод, основанный на получении эмиссионных спектров анализируемого вещества на фотографической пластине, получил название фотографического атомно-эмиссионного спектрального анализа (5).
Методы эмиссионного спектрального анализа основаны на измерении длины волны, интенсивности и других характеристик света, излучаемого газообразными атомами вещества. Атомы вещества испускают или поглощают свет определенной длины волны, который можно разложить на набор линий в спектроскопе, спектрографе и спектрофотометре. Основные составные части атомного (пламенного) эмиссионного спектрофотометра представлены на рис. 4.3.
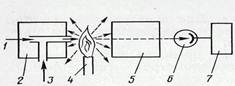
Рисунок 4.3 – Схема устройства пламенного эмиссионного спектрофотометра: 1– воздух из компрессора; 2 – распылитель; 3 – образец; 4 – горелка; 5 – монохроматор или фильтр; 6 – детектор; 7 – регистрирующее устройство
Спектральные линии элементов в полученном спектре позволяют судить о качественном составе анализируемой пробы, а по результатам измерения относительных почернении спектральных линий гомологической пары и их сравнению с соответствующими величинами стандартных образцов проводят количественный анализ компонентов пробы. Почернение спектральных линий измеряют при помощи микрофотометров фотоэлектрическим способом.
Рассматриваемый метод отличается высокой абсолютной чувствительностью и достаточно высокой воспроизводимостью при определении низких концентраций анализируемых веществ.
В лабораторной и заводской практике заводов пищевой промышленности используются отечественные спектрографы с кварцевой оптикой ИСП-30, ДФС-8, а также спектрографы со стеклянной оптикой ИСП-51 и ДФС-10.
В атомно-абсорбционной спектроскопии, так же как и в молекулярной, действует закон Бегера-Ламберта-Бера.
Атомно-абсорбционный метод анализа получил широкое распространение в практике вследствие своих достоинств, к числу которых относится высокая чувствительность. В настоящее время известны методы определения более восьмидесяти элементов, среди которых жизненно важные – Na, К, Mg, Ca, Сu, Zn, Р и микроэлементы – Cd, Hg, В, Pb, Sb, As, Mn и др. Количественные определения проводят методом калибровочного графика или методом добавок.
Для визуального наблюдения спектра используют спектроскопы.
Спектроскоп, предназначенный для эмиссионного анализа, получил название стилоскоп (3), а для спектрального анализа по спектрам испускания – стилометр (2). Последний позволяет не только наблюдать спектр, но и количественно измерять относительную интенсивность спектральных линий.
Рабочая область слектроскопов ограничена видимой частью спектра и составляет (0,39-0,70) •10-6 м. Переносной отечественный стилоскоп СЛП-2 является удобным прибором для проведения экспресс анализов в производственных условиях, а в заводских лабораториях используют стилоскоп СЛ-11А или стиломеры СТ-7.
Для атомизации вещества в атомно-абсорбционной спектрофотометрии используют пламя газовых сред различного типа и электротермические атомизаторы. Пламенная атомизация обеспечивает достаточно низкие пределы обнаружения элементов (10-5-10–7 %) и хорошую воспроизводимость результатов анализа (1-2 %) при достаточно высокой скорости определений и небольшой трудоемкости. Кроме того, этот анализ может быть полностью автоматизирован, начиная от подачи проб и до обработки результатов измерений. При этом производительность составляет до нескольких сотен определений в час.
В научно-исследовательских работах нашли применение качественные атомно-абсорбционные спектрофотометры типа «Спектр-1», «Сатурн», а также приборы зарубежных фирм типа «AAS-1» (Германия) и Perkin – Elmer (США).
1. Какой закон лежит в основе количественного колориметрического анализа?
2. Метод применения калибровочного графика в фотометрии.
3. Метод добавок в фотометрии.
4. Какие приборы используются в фотометрии?
5. Принцип работы фотоэлектроколориметра и спектрофотометра.
6. Какой метод анализа применяется при исследовании мутных растворов?
7. Что такое флуоресценция?
8. Достоинства и недостатки колориметрического и спектрофотометрического методов анализа.
9. На чем основаны методы эмиссионного спектрального анализа?
10. Принцип работы пламенного эмиссионного спектрофотометра.
11. Каково практическое применение атомно-абсорбционного метода анализа?
5 Поляриметрический и полярографический методы анализа
Поляриметрический метод анализа применяется для измерения угла поворота плоскости поляризации света при пропускании его через оптически активную среду раствора проводят с помощью поляриметров.
Полярографический методы анализа основаны на применении количественного полярографического метода: расчетный метод, калибровочного графика, стандартных растворов и метод добавок.
(1) Сахариметры – специально созданные для аналитического контроля, позволяющие быстро выполнять поляриметрические определения массовой доли сахарозы.
(2) Удельное вращение [] – угол поворота плоскости поляризации, который получился бы, если бы луч прошел во вращающей среде путь l=1 дм при концентрации вещества С, равным 1 г/см3.
(1) Полярографический метод – метод, основанный на регистрации силы тока при постепенном линейном увеличении напряжения на электродах ячейки, погруженных в исследуемый раствор.
5.1 Поляриметрический метод анализа. Виды поляриметров
Свет всегда поляризован, т. е. имеет неэквивалентность различных направлений в плоскости, перпендикулярной световому лучу.При прохождении такого света через оптически активные вещества (чаще всего органические соединения с асимметрическим атомом углерода) происходит изменение угла вращения плоскости поляризации (рис.5.1).
Плоскости поляризации двух половин P1 и Р2 составляют между собой малый угол 2a. Если плоскость поляризации анализатора АА перпендикулярна биссектрисе 2 a (а), обе половины I и II поля зрения имеют одинаковую полутеневую освещенность. При малейшем повороте анализатора относительная освещенность I и II резко меняется (б и в).
Из теории поляриметрии следует, что угол поворота плоскости поляризации пропорционален концентрации оптически активного вещества. На практике применяют понятие «удельное вращение» [ a ] (2) – угол поворота плоскости поляризации, который получился бы, если бы луч прошел во вращающей среде путь l =1 дм при концентрации вещества С =1 г/см3 (далее концентрация веществ приводится в скобках) в свете с длиной волны l при температуре t, т. е. угол поворота a составляет
a = [a]l t Cl. (5.1)
Показатель удельного вращения [a]lt характеризует растворение вещества в определенном растворителе.

Рисунок 5.1 – Полутеневые поляризаторы
Измерение угла поворота плоскости поляризации света при пропускании его через оптически активную среду раствора проводят с помощью поляриметров. Принципиальная схема полутеневого поляриметра дана на рис. 5.2.

Рисунок 5.2 – Принципиальная схема полутеневого поляриметра:
1 – источник света; 2 – конденсатор; 3 – полутеневой поляризатор; 4 – трубка с исследуемым оптическим активным веществом; 5 – анализатор с отсчетным устройством; 6 – зрительная труба; 7 – окуляр отсчетного устройства
Разновидностью поляриметров являются сахариметры (1), специально созданные для аналитического контроля, позволяющие быстро выполнять поляриметрические определения массовой доли сахарозы.
5.2 Полярографический методы анализа. Виды количественного полярографического метода: расчетный метод, калибровочного графика, стандартных растворов и метод добавок
Полярографический метод (1) основан на регистрации силы тока при постепенном линейном увеличении напряжения на электродах ячейки, погруженных в исследуемый раствор (рис. 5.3). Одним из электродов является капельный ртутный электрод. Полученные кривые зависимости «ток-потенциал» (полярограммы) позволяют судить о природе реагирующих веществ по величине потенциала, а о концентрации – по величине предельного тока.
В основе количественного полярографического анализа лежит линейная (на определенном участке) зависимость между высотой полярографической волны и концентрацией вещества в растворе. Найдяпо графику высоту волны либо замерив пропорциональную ей величину предельного тока, можно определить концентрацию. Существует несколько методов количественного полярографического анализа: расчетный, калибровочного графика, стандартных растворов, добавок.

Рисунок 5.3 – Принципиальная схема полярографа:
1 – капающий ртутный электрод; 2 – ртутный анод; 3 – источник постоянного тока; 4 – самопишущий регистратор напряжения тока; 5 – усилитель; 6 – аккумулятор
Количественный полярографический анализ построен на уравнении Ильковича, связывающего величину диффузного тока iД с концентрацией иона С:
iД = 607 D 1/ z m 3/ z t 1/ z C, (5.2)
где D – коэффициент диффузии;
z – заряд иона;
т – масса ртути, вытекающей из капилляра за 1 с, мг;
t – время образования капли (период капания), с.
В практике полярографического анализа коэффициент пропорциональности между С и iД устанавливается,как правило, с помощью стандартных растворов, поэтому уравнение (5.2) при условии D, т, t = const переходит в следующий вид:
iД = k C. (5.3)
Расчетный метод применяется сравнительно редко. Чаще пользуются методом калибровочного графика. График строят по 5-7 стандартным растворам, для которых полярограммы снимают в строго идентичных условиях. В этих же условиях полярографируют в дальнейшем и исследуемый раствор. Методом стандартных растворов вначале снимают полярограмму исследуемого раствора, а затем стандартного с известной концентрацией определяемого вещества.
Если в анализируемом растворе присутствует несколько электроактивных веществ, то на полярограмме можно получить раздельные пики каждого вещества. Варьируя состав фона и его концентрацию, можно добиться лучшего разделения пиков определяемых веществ.
Разрешающая способность и чувствительность полярографии переменного тока выше, чем у обычной полярографии. В полярографах различных типов на электрическую ячейку подается плавно изменяющееся с определенной скоростью напряжение, а возникающий ток регистрируется специальным устройством.Суть переменнотоковой полярографии в том, что на электроды наряду с постоянным поляризующим напряжением, которое постепенно нарастает, подается небольшое переменное напряжение. С началом электролиза через ячейку проходит переменный ток, который достигает максимального значения при потенциале полуволны. Высота максимума на полярограмме пропорциональна концентрации.
Концентрацию определяемого вещества в исследуемом растворе находят из уравнения
Cx = Cст hx / hст, (5.4)
где Сст – концентрация исследуемого стандартного раствора, мкг/см3;
hх,hст – высота волны для раствора соответственно исследуемого и стандартного, мм.
Методом добавок анализ проводят следующим образом. Анализируют исследуемый раствор и определяют высоту его волны hx, затем к нему добавляют стандартный раствор в таком количестве, чтобы высота волны раствора с добавкой возросла примерно вдвое. Снимают полярограмму раствора с добавкой, при этом находят hх+ст. Концентрацию вещества в исследуемом растворе Сx определяют по формуле
Cx = Cст hx / (hх+ст – hx.). (5.5)
При использовании этого метода полностью устраняются ошибки, вносимые фоном и другими артефактами.
В практике полярографического анализа используются как отечественные приборы типов ППТ-1, ПУ-1, так и зарубежные типов LP-7, LP-60 и типов ОН-104, ОН-105, в которых полярограмма записывается на диаграммной ленте.
Для массовых определений оптимальный диапазон концентраций для полярографии равен 10–2-10-5 моль/дм3, а погрешность аналитических результатов не превышает ±2%.
Данным методом можно определять хроматы, иодаты, молибдаты, ванадаты, анионные хлоридные комплексы вольфрама, олова и молибдена, а также наличие кадмия, свинца, хрома, олова, цинка, никеля, алюминия, железа и других металлов.
В настоящее время разработан ряд эффективных полярографических методик и для определения органических соединений, в частности органических галогенидов, альдегидов, кетонов, хинонов, гидрохинонов, меркаптанов, дисульфидов, сулъфоксидов, нитро- и нитрозосоединений, азосоединений, олеинов и др.
1. На чем основан поляриметрический метод анализа?
2. Что такое удельное вращение плоскости поляризации?
3. Принцип работы полутеневого поляриметра.
4. На чем основан полярографический метод анализа?
5. Какие методы используются для количественного определения вещества в полярографии?
6. На чем построен количественный полярографический анализ?
6 Радиометрический метод анализа
Загрязнение пищевых продуктов радиоактивными веществами (радионуклидами) небезопасно для здоровья человека. Контроль пищи растительного и животного происхождения осуществляют лаборатории, оборудованные соответствующими приборами и имеющие в штате подготовленных работников с помощью радиометрического метода анализа.
(1) Активность миллиграмм-эквивалента радия (мг-экв. Ra) – обладает такое количество радионуклида, которое создает такую же мощность дозы, как и 1 мг радия, заключенного в фильтр из платины толщиной0,5 мм.
(2) Активностью вещества – мера количества радиоактивного вещества, выражаемая числом радиоактивных превращений в единицу времени.
(3) Единица поглощенной дозы излучения (Дж/кг) – это поглощенная доза излучения, переданная массе облучаемого вещества в 1 кг и измеряемая энергией в 1 Дж.
(4) Кюри (Ки) – это активность такого количества вещества, в котором происходит 3,7.1010 актов распада в одну секунду. Единица активности Ки соответствует активности 1 г радия.
(5) Мощность поглощенной и экспозиционной доз – поглощенная и экспозиционная дозы излучения, отнесенные к единице времени.
(6) Период полураспада – время, в течение которого распадается половина всех атомов радиоактивных веществ.
(7) Поглощенная доза – энергия, поглощенная единицей массы облучаемого вещества.
(8) Рад – это поглощенная доза, при которой количество поглощенной энергии в 1 г любого вещества составляет 100 эрг независимо от вида и энергии излучения.
(9) Радиоактивность – это способность некоторых химических элементов (урана, тория, радия, калифорния и др.) самопроизвольно распадаться и испускать невидимые излучения. Такие элементы называют радиоактивными.
6.1 Радиоактивность и активность веществ. Понятие «поглощенная и экспозиционная доза». Приборы для определения радиологического заражения пищевых продуктов и воздуха
Радиоактивность (9) – это способность некоторых химических элементов (урана, тория, радия, калифорния и др.) самопроизвольно распадаться и испускать невидимые излучения. Такие элементы называют радиоактивными.
Радиоактивные вещества распадаются со строго определенной скоростью, измеряемой периодом полураспада (6), т. е. временем, в течение которого распадается половина всех атомов. Радиоактивный распад не может быть остановлен или ускорен каким-либо способом. Распад радиоактивных ядер сопровождается ионизирующим излучением. Скорость распада А пропорциональна числу ядер радионуклида:
А = Nl, (6.1)
где N – число ядер радионуклида;
l – постоянная распада, характеризующая вероятность распада за единицу времени (доля общего числа атомов изотопа, распадающихся каждую секунду).
Постоянная распада связана с периодом полураспада Т соотношением
T = 0,693 / l. (6.2)
Активностью вещества (2) называется мера количества радиоактивного вещества, выражаемая числом радиоактивных превращений в единицу времени.
В системе СИ за единицу активности принято одно ядерное превращение в секунду (расп./с). Эта единица носит название беккереля (Бк). Внесистемной единицей измерения активности является кюри (Ки) (4).
Ки – это активность такого количества вещества, в котором происходит 3,7.1010 актов распада в одну секунду. Единица активности Ки соответствует активности 1 г радия.
Для измерения малой активности пользуются производными величинами: милликюри (1 мКи = 10-3 Ки), микрокюри (1 мкКи = 10-6 Ки).
Для определения активности источников γ-излучения чаще всего пользуются специальной единицей измерения – миллиграмм-эквивалент радия (мг-экв. Ra). Активностью 1 мг-экв. Ra (1) обладает такое количество радионуклида, которое создает такую же мощность дозы, как и 1 мг радия, заключенного в фильтр из платины толщиной0,5 мм.
Удельная активность выражается различными единицами измерений: Бк/см3, Бк/г, Ки/дм3, Ки/кг, Бк/м3 и т. д.
Степень, глубина и форма лучевых поражений прежде всего зависит от величины поглощенной биологическим объектом энергии излучения. Для характеристики этого показателя используют понятий поглощенной дозы (7), т. е. энергии, поглощенной единицей массы облучаемого вещества.
За единицу поглощенной дозы (3) излучения принимают джоуль на килограмм (Дж/кг) – это поглощенная доза излучения, переданная массе облучаемого вещества в 1 кг и измеряемая энергией в 1 Дж.
В радиационной гигиене широкое применение получила внесистемная единица – рад (8) – это поглощенная доза, при которой количество поглощенной энергии в 1 г любого вещества составляет 100 эрг независимо от вида и энергии излучения. Производными данной единицы являются миллирад (1 мрад = 10-3 рад) и микрорад (1 мкрад =10-2 рад).
Внесистемной единицей экспозиционной дозы рентгеновского и -излучения является рентген (Р). Величины 0,114 эрг/см3 и 87,7 эрг/г принято называть энергетическими эквивалентами рентгена. Соотношение между поглощенной дозой излучения, выраженной в радах, и экспозиционной дозой, выраженной в рентгенах, для воздуха имеет вид
Dэксп = 0,877 Dпогл. (6.3)
Поглощенная и экспозиционная дозы излучения, отнесенные к единице времени, называются мощностью поглощенной и экспозиционной доз (5).
Биологические эквивалентом рентгена (бэр) в системе СИ является зивер (Зв).
Для обнаружения и измерения радиоактивных излучений используют приборы различных типов.
Детекторы ионизирующих излучений применяют для обнаружения ионизирующего излучения и измерения его энергии. Действие большинства детекторов основано на обнаружении эффекта от ионизации или возбуждения атомов или молекул вещества ионизирующим излучением. К ним относятся детекторы с ионизационными камерами и газоразрядными счетчиками. Детекторы, в которых используется эффект флуоресценции, называют сцинтилляционными счетчиками. Фотографические детекторы позволяют измерить уровень ионизирующих излучений по плотности почернения фотоматериалов, а химические – по результатам различных химических реакций (ферросульфатный детектор, детектор на основе четыреххлористого углерода, нитратный детектор).
Чаще всего в радиометрических измерениях используют сцинтилляционные счетчики, обладающие рядом достоинств:
- они универсальны с точки зрения возможности регистрации ионизирующих излучений практически любых видов;
- дают возможность измерять энергию исследуемых частиц или квантов; обладают высокой разрешающей способностью и высокой эффективностью регистрации γ-излучения (до нескольких процентов).
Современный сцинтилляционный счетчик состоит из сцинтиллятора – вещества, способного испускать видимое излучение под действием заряженных частиц, и фотоэлектронного умножителя (ФЭУ), в котором энергия световых вспышек (сцинтилляции) преобразуется в импульсы электрического тока.
Приборы отечественного производства для радиационной разведки и дозиметрического контроля (ДП-5В, СРП-68-01, ДП-100, РКБ-4, КРБ-1) широко используются для контроля пищевых продуктов и питьевой воды.
1. Что такое радиоактивность вещества?
2. Что называется периодом полураспада?
3. Какие единицы измерения величин используются в радиометрическом методе анализа?
4. Какие приборы используются для обнаружения и измерения радиоактивных излучений?
7 Хроматографические методы анализа
Методики, основанные на использовании хроматографических методов разделения, довольно разнообразны и позволяют успешно исследовать практически любые пищевые продукты.
Благодаря высокому уровню развития экспериментальной техники и инструментального оснащения современные хроматографические методы позволяют с большой степенью точности и воспроизводимости решать сложные аналитические задачи, стоящие перед работниками лабораторий контроля качества пищевых продуктов, полуфабрикатов и сырья. В последние годы вследствие усовершенствования хроматографического метода были достигнуты высокая эффективность, значительная скорость разделения, что позволило использовать его и как микроаналитический метод.
(1) Адсорбционная хроматография – хроматография, проводимая за счет адсорбционного равновесия между неподвижной твердой и подвижной жидкой фазами.
(2) Адсорбционная хроматография газожидкостная – хроматография, проводимая за счет равновесного распределения между неподвижной жидкой и подвижной газовой фазами.
(3) Адсорбционная хроматография ионообменная – хроматография, проводимая за счет равновесия между ионообменной смолой и электролитом (подвижная фаза).
(4) Адсорбционная хроматография на бумаге – хроматография, проводимая за счет равновесного распределения между неподвижной жидкой и подвижной жидкой фазами.
(5) Аффинная хроматография – хроматография, проводимая за счет равновесного связывания макромолекулы с молекулой малой, по отношению к которой она проявляет высокую специфичность.
(6) Проникающая хроматография – хроматография, проводимая за счет равновесия между жидкой фазой на внутренней и внешней поверхностях пористой структуры или «молекулярного сита».
(7) Хроматография – метод, основанный на разделении сложных смесей на составные компоненты между двумя несмешивающимися фазами, из которых одна подвижная, а другая неподвижная.
(1) Внутренний стандарт – соединение, которое по физическим свойствам очень близко к исследуемому, и при хроматографировании движется вдоль колонки.
(2) Временем удерживания – время (температура, скорость пропускания газа-носителя и т. д.) прохождения анализируемого соединения через колонку, является постоянной величиной.
(1) Гель-фильтрация – разделение веществ при помощи гелей, основанное на разделении молекул по размерам при пропускании через плотное молекулярное сито.
7.1 Классификация хроматографических методов анализа
Хроматография (7) основана на разделении сложных смесей на составные компоненты между двумя несмешивающимися фазами, из которых одна подвижная, а другая неподвижная.
Существенным признаком хроматографического процесса является его динамический характер. В ходе процесса происходит перемещение подвижной фазы, содержащей анализируемую пробу, через неподвижную фазу. Причем взаимодействие «сорбция–десорбция» повторяется многократно, что обусловливает высокую эффективность хроматографического разделения.
Подвижная фаза может быть жидкой, твердой или представлять собой смесь жидкой или газообразной фаз и обычно перемещается по неподвижной фазе или пропускается через нее. По характеру разделения хроматографические методы анализа делятся на 4 группы:
адсорбционная хроматография (1) – за счет адсорбционного равновесия между неподвижной твердой и подвижной жидкой фазами;
распределительная хроматография и ее разновидности:
- на бумаге (4) – за счет равновесного распределения между неподвижной жидкой и подвижной жидкой фазами;
- в тонком слое;
- газожидкостная (2) – за счет равновесного распределения между неподвижной жидкой и подвижной газовой фазами;
- ионообменная (3) – за счет равновесия между ионообменной смолой и электролитом (подвижная фаза);
- проникающая хроматография (6) – за счет равновесия между жидкой фазой на внутренней и внешней поверхностях пористой структуры или «молекулярного сита»;
- аффинная хроматография (5) – за счет равновесного связывания макромолекулы с молекулой малой, по отношению к которой она проявляет высокую специфичность.
7.2 Адсорбционная хроматография
Разделение при адсорбционной хроматографии основано на различной адсорбируемости компонентов анализируемой смеси на адсорбенте. Эти свойства в основном определяются молекулярной структурой соединений. Вещество с более высоким коэффициентом распределения передвигается по поверхности адсорбента с большей скоростью. Если соединения окрашены, то при их разделении можно видеть окрашенные полосы (рис.7.1).

Рисунок 7.1 – Этапы хроматографического разделения на колонке:
а – поступление смеси на стартовую точку; б – опережение одного компонента другим; в – появление на выходе
Разделяемую пробу можно собрать в виде фракций пропусканием соответствующего растворителя через колонку, а затем производить анализ. Эффективность разделения во многом зависит от правильного выбора адсорбента.
Адсорбенты, применяемые в колоночной хроматографии, представлены в таблице 7.1.
Таблица 7.1 – Адсорбенты в колоночной хроматографии
| Адсорбент | Разделяемые соединения |
| Силикагель | Аминокислоты, углеводы, жирные кислоты, липиды, эфирные масла, неорганические катионы и анионы, алкалоиды |
| Оксид алюминия | Витамины, аминокислоты, пищевые красители, фенолы, алкалоиды, каротиноиды, стероиды |
| Целлюлоза | Аминокислоты, пищевые красители, нуклеотиды |
| Крахмал | Аминокислоты |
| Сефадекс | Белки, аминокислоты |
| Целлюлоза ионообменная | Нуклеотиды |
7.3 Распределительная хроматография: на бумаге, в тонком слое, газожидкостная и ионообменная
Распределительная хроматография осуществляется на колонках (газожидкостная и колоночная хроматография) либо на специальной хроматографической бумаге (распределительная хроматография на бумаге).
Хроматографическая бумага обладает свойством задерживать воду между волокнами. Эту воду можно рассматривать как один из растворителей (неподвижная фаза). Если бумагу поместить в слой неводного растворителя, то под воздействием капиллярных сил неводный растворитель (подвижная фаза) будет перемещаться и молекулы анализируемого вещества, предварительно нанесенного на хроматографическую бумагу, будут распределяться между фазами в соответствии с их коэффициентом распределения Rf. Каждое вещество характеризуется своей величиной Rf
В идеальном случае Rf определяется только природой вещества, параметрами бумаги и свойствами растворителей и не зависит от концентрации вещества и присутствия других компонентов.
По технике выполнения различают следующие виды хроматографии на бумаге: одномерную, двухмерную и круговую.
Первые два вида могут быть получены в восходящем и нисходящем потоке растворителей (рис. 7.2). Однако двумерная хроматография открывает более широкие возможности в разделении сложных смесей, чем одномерная.
К хроматографической бумаге и растворителям предъявляются определенные требования: бумага должна быть однородной по плотности, химически чистой и инертной по отношению к разделяемым компонентам и подвижному растворителю; объемные соотношения растворителей приведены в таблице 7.2.
При использовании тонкослойной хроматографии (ТСХ)сорбент распределяют тонким слоем (0,25-5,00 мм) на стеклянные или металлические пластинки. Пробу в виде пятна наносят при помощи микропипетки на расстоянии примерно 2,5 см от нижнего края пластинки. Разделение проводят в стеклянной камере, на дно которой налит растворитель слоем 2 см. Пластинку оставляют в камере на определенное время для уравновешивания в закрытом состоянии.
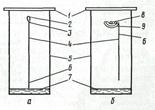
Рисунок 7.2 – Восходящая (а) и нисходящая (б) хроматография на бумаге: 1 – крышка; 2 – держатель; 3 – зажим; 4 – бумага; 5 – стеклянная камера; 6 – место нанесения пробы; 7 – растворитель; 8 – стеклянная палочка; 9 – лоток с растворителем
Таблица 7.2 – Объемные соотношения растворителей, используемые в распределительной хроматографии
| Анализируемые соединения | Растворители |
| Аминокислоты | н-Бутанол–уксусная кислота–вода (40:10:50) н-Бутанол–пиридин–вода (33:33:33) метанол–пиридин–вода (25:12:63) |
| Углеводы | н-Бутанол–пиридин–вода (50:28:22) |
| Хлорофиллы и каротиноиды | 1-Пропанол–петролейный эфир (4:96) хлороформ–петролейный эфир (30:70) |
Многие специальные сорбенты для тонкослойной хроматографии содержат флуоресцирующие красители, поэтому после разделения можно просматривать пластины в ультрафиолетовом свете и при этом отдельные компоненты разделяемой смеси выявляются на них в виде окрашенных пятен.
При тонкослойной хроматографии для разделения веществ применяют ряд растворителей, приведенных в таблице 7.3.
Таблица 7.3 – Системы растворителей для тонкослойной хроматографии
| Анализируемые соединения | Адсорбент | Растворители |
| Аминокислоты | Силикагель | Этанол 96%-ный–вода (70:30) Бутанол–уксусная кислота–вода (80:20:20) |
| Углеводы | Кизельгур | Этилацетат-1–пропанол (65:35) Н-Бутанол–ацетон–фосфатный буфер рН 5 (40:50:10) |
| Нейтральные липиды | Силикагель | Петролейный эфир–диэтиловый эфир–ацетон (90:10:1) |
| Фосфолипиды | Силикагель | Хлороформ–метанол–вода (65:25:10) |
| Каротиноиды | Кизельгур | Петролейный эфир-1–пропанол (99:1) |
Эффективность разделения можно повысить с помощью двухмерной хроматографии (рис. 7.3).

Рисунок 7.3 – Двухмерная хроматограмма
Метод газожидкостной хроматографии (ГЖХ) основан на распределении анализируемых соединений между жидкой и газовыми фазами. Благодаря высокой чувствительности и быстроте разделения он используется для количественного и качественного анализов. Принципиальная схема газожидкостного хроматографа приведена на рис. 7.4.
Основное преимущество данного вида хроматографии перед другими методами заключается в том, что благодаря большой скорости десорбции разделяемых компонентов в газовой среде можно значительно ускорить продвижение проявителя (газа-носителя) и тем самым ускорить процесс разделения.
Например, анализ пятикомпонентной смеси летучих углеводородов, спиртов, жирных кислот, эфиров и т. д. на газовом хроматографе с высокочувствительным детектором может быть проведен за 5 мин.

Рисунок 7.4 – Принципиальная схема газожидкостного хроматографа (а) пламенно-ионизационного детектора (б): 1 – детектор; 2 – усилитель; 3 – самописец; 4 – интегратор; 5 – место введения пробы; 6 – устройство, регулирующее температуру термостата; 7 – хроматографическая колонка; 8 – термостат; 9 – запальное устройство; 10 – выходное отверстие; 11 – пламя; 12 – электрод
По полученным хроматографическим кривым можно определить количественный состав анализируемой смеси путем измерения высоты максимумов пиков, а также найти произведение удерживаемого объема разделяемых веществ на высоту пиков.
Площадь пиков в данном случае находят с помощью планиметра, взвешиванием на аналитических весах вырезанного из бумаги пика и сравнением с массой куска той же бумаги известной площади, либо умножением половины высоты пика на его ширину. Удерживаемый объем рассчитывают по оси объемов от момента ввода порции анализируемой пробы до момента достижения максимума пика.
В стандартных условиях (температура, скорость пропускания газа-носителя и т. д.) время прохождения анализируемого соединения через колонку является постоянной величиной и называется временем удерживания (2). При количественном анализе в ГЖК используют внутренний стандарт (1) – соединение, которое по физическим свойствам очень близко к исследуемому, и при хроматографировании движется вдоль колонки.
Отечественная промышленность выпускает хроматографы лабораторного и промышленного типов, обладающие чувствительностью, для некоторых типов 510-14 моль/с.
В основе ионообменной хроматографии многих соединений (аминокислот, органических кислот, сахаров и т. д.) лежит способность к ионизации, обусловливающая суммарный положительный или отрицательный заряд.
Разделение веществ с помощью этого вида хроматографии проводят на колонках, заполненных ионообменной (катионо- или анионообменной) смолой. Набухшую смолу помещают в колонку (рис. 7.5) и подвергают регенерации, пропуская через нее раствор НС1 молярной концентрацией 1 моль/дм3 (для катионообменной) или NaOH той же концентрации (для анионообменной). Затем колонку промывают дистиллированной водой до полного удаления регенерирующего вещества, после чего она готова к хроматографированию. Этот принцип используется во всех промышленных приборах – автоматических аминокислотных анализаторах.
Для разделения ионообменной хроматографией высокомолекулярных соединений (белков, нуклеотидов и др.) в качестве фильтра широко применяется модифицированная целлюлоза.

Рисунок 7.5 – Хроматографическая колонка упрощенного (а) и усовершенствованного (б) вариантов: 1 – резервуар; 2 – элюирующий раствор; 3 – стеклянная колонка; 4 – наполнитель; 5 – стеклянная вата; 6 – осуд Мариотта с элюирующим раствором; 7 – регулирующий поршень; 8 – сетка из нейлона; 9 – капиллярный шланг, соединенный с регистрирующим устройством и (или) коллектором фракций
7.4 Проникающая и аффинная хроматография
Метод проникающей хроматографии заключается в разделении молекул по размерам при пропускании через плотное молекулярное сито.
Разделение веществ при помощи гелей, основанное на том же принципе, называется гель-фильтрацией (1).
В качестве молекулярного сита при проникающей хроматографии используют гели с поперечными сшивками (сефадексы) агарозные гели (сефароза, биогель-А), полиакриламидный гель (биогель-Р) и полистиролы (биобидз-S), а также пористые стеклянные шарики (биоглас) и пористый кварц (поросил). Изменяя число поперечных сшивок, удается получать несколько типов сефадексов, различающихся степенью пористости частиц, что позволяет успешно применять их для разделения веществ с различными размерами молекул.
При проникающей хроматографии также пользуются колонками. В последнее время для разделения аминокислот, углеводов, стероидов и липофильных соединений применяют тонкослойную гель-филътрацию на пластинках.
В основе метода аффинной хроматографии лежит уникальное свойство макромолекул – биологическая специфичность, что позволяет при разделении получать вещества высокой степени чистоты. Поэтому аффинная хроматография успешно применяется для очистки белков, витаминов, ферментов и других высокомолекулярных соединений.
Для разделения веществ методом аффинной хроматографии необходимо точно знать кинетические свойства исследуемых соединений, например ферментов.
При очистке всех видов макромолекул методом аффинной хроматографии наблюдается следующее:
М+Л (К+1)/(К-10)→МЛ. (7.2)
Его эффективность (а, следовательно, и очистки) зависит от природы образующегося комплекса МЛ (Л – лиганд для матрицы).
Чтобы правильно выбрать лиганд для этого процесса, необходимо знать свойства подлежащих очистке макромолекул. Лиганд должен содержать химическую группу, которая не участвует в связывании лиганда с макромолекулой, но посредством которой идет его сшивание с матрицей. Чтобы в процессе сшивания не нарушалась способность к связыванию, целесообразно использовать специальные удлиняющие «мостики» (чаще всего это диамины типа NH2(CH2)х–NH2, где Х=2-6).
Колонка для аффинной хроматографии заполняется связанной с лигандом матрицей и уравновешивается буферным раствором, который используется для растворения исследуемого вещества.
Идеальная нерастворимая матрица для аффинной хроматографии должна содержать большое число химических групп, способных ковалентно связываться с лигандом, не разрушаться при связывании и последующей элюации макромолекул, обеспечивать быстрое протекание растворителя. Обычно в качестве матрицы применяют агарозу, синтетические полиакриламидные гели, полистирольные смолы и пористые стеклянные шарики.
1. На чем основан хроматографический метод анализа?
2. Виды и классификация хроматографии.
3. Каковы этапы адсорбционного хроматографического разделения на колонке?
4. Какие адсорбенты применяются в колоночной хроматографии?
5. Виды распределительной хроматографии.
6. Какие растворители и их смеси применяются при распределительной и тонкослойной хроматографии?
7. Каков принцип работы газожидкостного хроматографа пламенно-ионизационного детектора?
8. В чем особенность колоночного ионообменного хроматографического разделения?
9. На чем основан метод проникающей хроматографии?
10. Что такое лиганд, принцип его выбора в аффинной хроматографии?
Список основной литературы
1. Журавская Н.К., Гутник Б.Е., Журавская Н.А. Технохимический контроль производства мяса и мясопродуктов – М.: Колос, 2001. – 476 с.
2. Антипова Л.В., Глотова И.А., Рогов И.А. Методы исследования мяса и мясных продуктов. – М.: Колос, 2001 – 376 с.
3. Марх А.Т., Зыкина Т.Ф., Голубев В.Н. Технохимический контроль консервного производства. – М.: Агропромиздат, 1999. – 304 с.
4. Лурье И.С., Шаров А.И. Технологический контроль сырья в кондитерском производстве. М.: Изд-во «Колос», 2001.352с.
Список дополнительной литературы
1. Химический состав пищевых продуктов. Справочник под ред. И.М. Скурихина. – М.: Агропромиздат, 1987.
2. Коростелев П.П. Лабораторная техника химического анализа. – М.: Химия, 1981.
3. Петров И.К. Технологические измерения и приборы в пищевой промышленности. – М.: Агропромиздат, 1985. – 343 с.
4. Хмельницкий Р.А. Современные методы исследования агрономических объектов. – М.: Высшая школа, 1981. – 256 с.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2636; Нарушение авторских прав?; Мы поможем в написании вашей работы!