
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ранние этапы.
| Не ракового роста | Ракового роста | ||
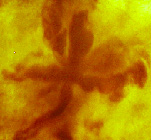 радиально-лучевя симметрия очагов тканевого роста радиально-лучевя симметрия очагов тканевого роста
| Вначале преобладает фаза "пролиферации", возникают радиально-лучисто симметричные объекты из "незрелых" тканевых структур. ("тяжелая дисплазия") | Первичные раковые тканевые структуры "рыхло" заполняют сферическую зону будущего очага "первого порядка" |  рак: шаровая симметрия очага рак: шаровая симметрия очага
|
 Высокий градиент структурной анизотропии по векторам роста Высокий градиент структурной анизотропии по векторам роста
| Позже к периферии очагов начинается созревание тканевых структур, пролиферация эпителия сохраняется только у центра очагов роста. | После достижения определенной плотности тканевых структур от "очага первого порядка" (1) отпочковываются очаги последующих порядков (2).

|  рак: низкий градиент структурной анизотропии от центра к периферии очага рак: низкий градиент структурной анизотропии от центра к периферии очага
|
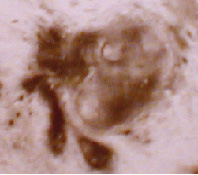 Начало формирования "фиброаденомы" в молочной железе (очаг в толще органа) Начало формирования "фиброаденомы" в молочной железе (очаг в толще органа)
| При ранней ассиметризации очагов формообразования новообразованные тканевые структуры принято относить к "аденомам". |  рак: гистопрепарат узелка очагами второго порядка рак: гистопрепарат узелка очагами второго порядка
| |
 Начало формирования "узловатого зоба" в щитовидной железе.(характерное для неракового роста градиентное нарастание структурной анизотропии с снижением выраженности "фазы пролиферации" по векторам укрупнения очага новообразования тканей).
Начало формирования "узловатого зоба" в щитовидной железе.(характерное для неракового роста градиентное нарастание структурной анизотропии с снижением выраженности "фазы пролиферации" по векторам укрупнения очага новообразования тканей).
| При поздней ассиметризации очагов формообразования, новообразованные структуры принято относить к "узловатым гиперплазиям" | На поздних этапах в центре раковых узлов возникают зоны деструкции, а активно растущие структуры смещаются на периферию узла |  Характерная для рака инверсия градиента структурной анизотропии с искажением симметрии сферы.
Характерная для рака инверсия градиента структурной анизотропии с искажением симметрии сферы.
|
Дополнительная литература:
1 - И.В. Давыдовский "Общая патология человека. М. Медицина 1969.стр.489-540.
2 - В.И. Даниленко - http://www.debryansk.ru/~dzint/journ/morph/text004.htm;
http://www.vsma.ac.ru/publ/priam/v2-1/part-4.html#1
http://www.vsma.ac.ru/publ/priam/v-3-2/part-1.html#7
СИММЕТРИЯ - КЛЮЧ К ПОНИМАНИЮ МОРФОГЕНЕЗА РАКА

| 
|
| Радиально лучевая симметрия - НЕ РАК | Концентрично-сферическая симметрия - РАК |
Догмой онкоморфологии остаются представления о том, что морфогенез рака есть линейная последовательность каких-то стадий (у каждого автора своих). Некоторые исследователи допускают возникновение рака скачкообразно (de novo). К сожалению оба подхода не касаются проблемы переходных состояний между явно разными качествами ("не опухоль" - "опухоль") и сути отличий так называемых "добро" и "злокачественных" опухолей, предполагают исследование морфогенеза рака только через анализ признаков. Однако согласно общенаучным данным (Г.П.Короткова, 1968; И.Пригожин, 1992) качественные отличия материальных систем выражаются не признаками, а свойствами (важнейшие из которых: тип симметрии, степень целостности, величина градиента структурной анизотропии). Четкость выраженности этих свойств позволяет объективно стадировать процессы развития. Иначе говоря, чем четче симметрия систем, тем на более ранней стадии своего развития они находятся. Учитывая это, мы провели поиск симметричных очагов патологического тканевого роста в органах где: во первых- часто встречаются "узловатые дисгормональные гиперплазии", "доброкачественные опухоли" и рак, во вторых- феномен симметризации уже описывался (Semb,1928; В.И.Даниленко, 1982, В.И.Даниленко, А.С.Ягубов, 1996)
Изучено трехмерное строение очагов патологического тканевого роста в молочных железах женщин (548 аутопсийных, 90 операционных случаев), крыс (20 животных - эксперимент с затравкой ДМБА), в щитовидных железах (32 аутопсийных, 40 операционных случаев), в простате (36 аутопсийных, 40 операционных случаев, в толстой кишке (21 операционный случай). Целые органы или их крупные части рассекались на серии толстых (3 - 5 мм) кристеллеровских срезов. После тотального прокрашивания и просветления анализировались все патологические тканевые структуры (ПТС) по всему объему исследованных органов. Тонкое строение симметричных очагов ПТС изучалось по прицельно ориентированным тонким срезам. Динамика изменений характеристик клеток вдоль патологических тканевых структур оценивалась с помощью методик морфометрии по параметрам пролиферативной активности и степени дифференцировки клеток.
Стереомикроскопическое изучение показало, что основная масса (более 80%) ПТС характерных для "узловатых гиперплазий", "добро" и "злокачественных" опухолей располагается в составе отдельных связных выделенных групп - очагов (ОПТС). Всего на 83 случая рака выделено 107 очагов, на 86 случаев "доброкачественных опухолей" - 211, на 699 случаев узловатых гиперплазий - 6309 очагов. Размеры ОПТС вариировали от 0,05 до 1 см (3,6+0,2 мм). То есть практически любое клинически опреляемое уплотнение вызванное патологическим ростом тканей является конгломератом очагов роста. Выяснилось, что поиски симметрии очагов затрудняются искажениями возникающими: 1 - при взаимоналожениях очагов, 2 - увеличении их размеров, 3 - при исследовании касательных срезов. Как целое очаги патологических тканевых структур воспринимаются только на срезах проходящих через их центры. Несмотря на все эти ограничения и искажения, при трехмерном исследовании выяснилось, что абсолютное большинство очагов является упорядоченными системами характерных тканевых структур. Эта упорядоченность не зависит от конкретного набора патологических тканевых структур (ПТС) в очаге и ярче всего проявляется в симметризации очагов. Сравнение строения ОПТС в трех изучаемых группах патологии ("узловатые гиперплазии", "добро" и "злокачественные" опухоли) показало, что имеется не три, а всего два типа пространственной организации очагов. Очаги неракового роста отличаются радиально-лучевой, а ракового - шаровой симметрией (см. выше). На сечениях через центр очагов эти симметрии выглядят как ромашко-лепестковая и концентрично- сферическая (см. выше). Конусовидные сектора очагов неракового роста являются связными зонами в которых по единой схеме (от фазы пролиферации к фазе дифференцировки) формируются любые нераковые тканевые структуры. Стереометрическое исследование 6520 очагов патологического тканевого роста позволило выяснить, что количество конусовидных лучистых зон составляющих очаги неракового роста не бывает другим кроме как 4, 6, 8, 12 или 20. ОПТС с высокими степенями четкости радиально-лучистой симметрии встречаются очень редко (доли процента от всех очагов неракового роста). Их конусовидные сектора всегда образованы солидными массами пролиферирующего эпителия. По мере снижения четкости симметрии очагов неракового роста активность пролиферации эпителия в них снижается. Доля структур с картинами выраженной пролиферации эпителия в высокосимметричных очагах составляет 69,6+0,6%, в средне симметричных - 27,1+0,5%, в слабо симметричных - 6,3+0,2%). Закономерность подтверждается и достоверно высокой корреляцией эмпирических и выравненных по прямой теоретических рядов значения ядерно-цитоплазматического индекса от центров очагов неракового роста к их периферии (r=0,89; z=1,422; t=5,36; P<0,01). При этом к периферии конусовидных зон начинается формирование конкретных тканевых структур из спектра возможных в данном органе, но своих в каждом отдельном секторе. При небольшом по объему и более или менее равномерном структурировании по секторам, радиально лучевая симметрия очагов неракового роста сохраняется долго. Если новообразование нераковых структур идет по секторам неравномерно, то структуры соседних секторов перемешиваются и симметрия очагов исчезает рано. Такие деформации наблюдаются наиболее выражено, если в одном из конусовидных секторов очагов неракового роста возникают структуры которые принято сейчас относить к "доброкачественным опухолям" ("аденомы", "фиброаденомы", "аденоматозные полипы" и др.). Разные пространственные сочетания разных количеств ОПТС находящихся на разных стадиях морфогенеза и объясняют ту пестроту гистологических картин, которая характерна для "мастопатии", "фиброаденом", "фиброаденоматозной гиперплазии" в молочной железе, "узловатых гиперплазий", "аденом" в щитовидной железе и простате.
Стереомикроскопическое исследование 107 очажков ракового роста показало, что все они представляют системы концентрических "орбит" на которых как "планеты" располагаются раковые тканевые структуры (РТС). Гистологически РТС могут выглядеть как любой этап морфогенеза любой нераковой тканевой структуры (чаще из характерных для данного органа) однако трехмерно это дискретные, лимитные по объему образования с особой пространственной организацией и способом роста. В раковых тканевых структурах расположение зон пролиферации и структурирования не изменяется во времени, не ориентировано на радиус очага, а замкнуто по циклоиде. Если РТС достаточно крупна, то можно видеть, что зона пролиферации составляет периферию, а зона структурирования - ее центр. Закономерность подтверждается и достоверной корреляцией эмпирических и выровненных по параболе рядов значений ядерно-цитоплазматического индекса полученным по случайным секущим проходящим через раковые структуры (r=0,62; z=0,25; t=2,99; P=0,01). Раковое формообразование состоит в том, что каждая раковая тканевая структура достигнув предельных для себя размеров (своих в каждом отдельном очаге) перешнуровываясь отпочковывает идентичную себе производную структуру в свободное от других РТС пространство. При этом на ранних стадиях морфогенеза "почкование" идет равномерно и возникает гомогенный шаровидный очаг. Позже наступает деструкция центра очага, появление вторичных очагов, снижение четкости симметрии. Таким образом показателем времени существования ракового узла являются не столько его размеры, сколько нарастающая деструкция центра и искажение шаровидной симметрии.
Разные пространственные сочетания разных количеств очагов неракового и ракового тканевого роста, находящихся на разных стадиях своего морфогенеза и объясняют трудности в интерпретации гистологических картин характерных для начала ракового роста.
Очаговость патологического тканевого роста, начало морфогенеза как неопухолевого, так и истинно опухолевого (ракового) роста от точки - центра очага указывает на существование необычных, "предельных" состояний тканей. Учитывая количество секторов (от 4 до 20) из которых состоят очаги патологического тканевого роста, можно полагать, что точка "предела" может быть оформлена только в виде шарообразного скопления из 4-20 абсолютно одинаковых, максимально недифференцированных клеток ("сфероид"). Выбор неракового (связного) или ракового(дискретного) способа тканевого формообразования определяется очевидно количеством частей ("осколков") на которое может разорваться "сфероид". Пока неясно почему когда из "сфероида" возникает 4, 6, 8, 12 или 20 частей начинается нераковый рост, а когда другое количество "осколков "- сразу возникает первая раковая тканевая структура, которая "почкуясь" дает начало морфогенезу очага ракового роста. Очевидно, что для понимания качественного своеобразия "предельных"состояний тканей потребуется своя система терминов, понятий и методов, свой подход (перспективнее всего на базе синергетики). Иначе говоря разнокачественные этапы морфогенеза рака не могут быть осознаны в одной (существующей сейчас) системе понятий. Для разрешения загадки рака необходимо исследование не каких-то абстрактных "пролифератов", а конкретных "сфероидов". Наша попытка генерации "сфероидов" в молочных железах крыс в эксперименте с затравкой ДМБА показала, что эти объекты очевидно существуют очень недолго (часы?). При суточной экспозиции обнаруживались уже качественно определенные очаги: либо радиально-лучисто симметричные (нераковые), либо сферичные фокусы ракового роста.
Выводы:
1-Элементарной структурной единицей болезней типа "узловатых гиперплазий", "доброкачественных опухолей" молочной, щитовидной желез, простаты, а также всех гистовариантов рака этих органов является очаг патологического тканевого роста (ОПТР). Именно разнообразие пространственных и временных сочетаний ОПТР и определяет пестроту гистологических классификаций и разноречивость мнений о морфогенезе этих болезней.
2 - Качественные различия неракового и ракового роста не зависят от гистологических вариантов новообразования патологических тканевых структур и проявляются в очагах патологического роста с самого начала их возникновения в разных типах симметризации, разных пространственных распределениях зон пролиферации и дифференцировки как по очагу в целом так и по отдельным структурам, разной степени связности новообразующихся тканевых структур.
3- Для решения загадки рака необходимо выяснить, что такое "сфероиды", как они возникают, почему когда они разделяются на 4, 6, 8, 12, 20 частей начинается нераковый рост, а когда образуется другое количество частей - раковый рост.
Гипертоническая болезнь(ГБ), Цереброваскулярные заболевания(ЦВБ), Кардиомиопатии (КМП).
1 - Гипертоническая болезнь и симптоматические гипертензии - основные понятия: Гипертензия- повышение гидростатического давления в сосудах, Гипертония - увеличение тонуса мышечного слоя стенки сосудов. Гипертоническая болезнь — заболевание сердечно-сосудистой системы, развивающееся вследствие первичной дисфункции (невроза) высших сосудорегулирующих центров и последующих нейрогормональных и почечных механизмов, характеризующееся артериальной гипертензией, функциональными, а при выраженных стадиях—органическими изменениями почек, сердца, центральной нервной системы. Симптоматические артериальные гипертензии — одно из проявлений (симптомов) определенного заболевания. Среди всех гипертензивных состояний вторичные артериальные гипертонии составляют примерно 20 %. Алгоритм различения гипертензий представлен на схеме.1
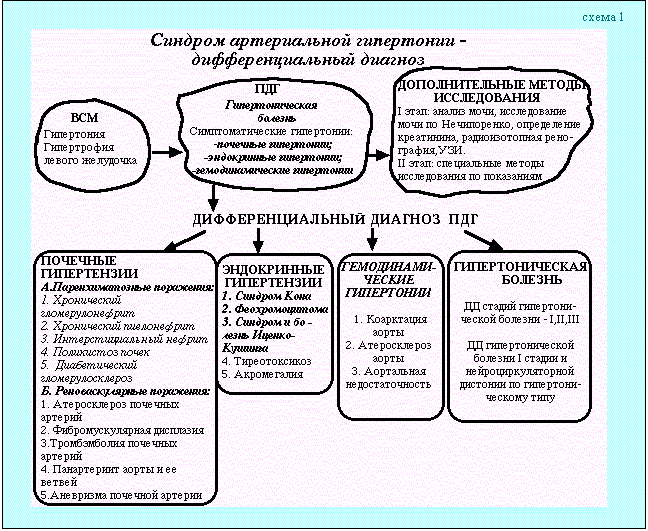
2 - «Гипертоническая болезнь» (эссенциальная артериальная гипертензия)-ГБ, может протекать в «добро» и «злокачественном» вариантах. Для "доброкачественного" течения гипертонической болезни (схема 2), характерны нарастающие изменения стенок мелких сосудов: вначале гипертрофия мышц, затем появление в стенке артериол эластических мембран, позже разрастания соединительной ткани и гиалиноз. Во второй стадии заболевания к изменениям сосудов присоединяется гипертрофия левого желудочка сердца. В третьей стадии ГБ (рис.1) развиваются "грубые" изменения в органах: гипертрофия сердца до 600-800 гр, изменения почек, кровоизлияния в сетчатку глаз. Особенно характерно "первичное сморщивание почек" (финал артериоло-нефросклероза, нефросклероза ангиогенного или нефросклероза гипертонического). Такое изменение почек ведет к хронической почечной недостаточности и смерти.
Схема 2.
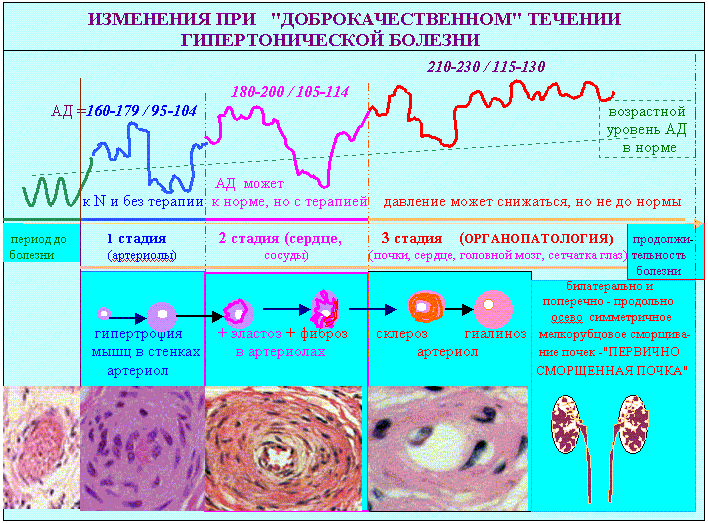
3 - При неадекватном лечении и других отягчающих обстоятельствах плавное, "доброкачественное" течение гипертонической болезни осложняется кризами. КРИЗ (приступ) - это внезапное кратковременное усиление проявлений болезни. Если кризов много, то болезнь приобретает "злокачественный "характер.
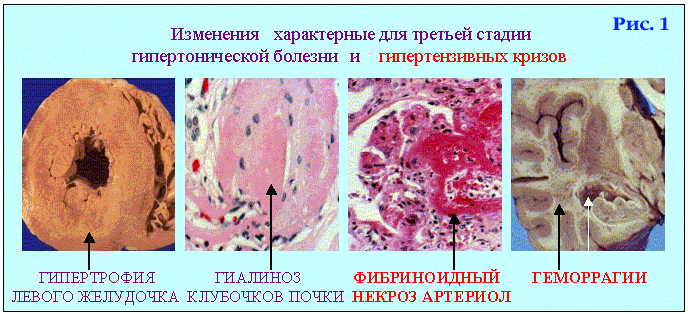
4 - Морфологические признаки злокачественной гипертонической болезни и гипертонического криза. ЗЛОКАЧЕСТВЕННАЯ гипертоническая болезнь - вариант течения с ранней потерей трудоспособности (доминируют проявления гипертензивного криза). Гипертензивный криз - одно из наиболее частых и тяжелых проявлений гипертонической болезни и симптоматических артериальных гипертензий, характеризующееся острым повышением артериального давления до индивидуально высоких цифр и резким обострением симптоматики заболевания с преимущественным преобладанием церебральных и сердечно-сосудистых расстройств. Криз морфологически проявляется: 1-гофрированностью и деструкцией базальной мембраны эндотелия артериол, 2-плазматическим пропитыванием и фибриноидным некрозом их стенок, 3- картинами тромбоза, сладжа и мелких геморрагий.(рис.1) В качестве основного заболевания гипертоническая болезнь в окончательном диагнозе может быть выставлена в случаях смерти: 1- от сердечно сосудистой недостаточности при гипертоническом кризе, 2- от уремии при первично сморщенной почке. В случаях поражений сердца (ИБС), мозга (ЦВБ) – гипертоническую болезнь принято сейчас рассматривать как фоновое заболевание.
5 - ЦВБ-определение, морфология транзиторной ишемии, геморрагического и ишемического инсультов в головном мозге.
Церебро васкулярные болезни - это группа заболеваний причиной которых являются ишемия ткани мозга вызванная сужением, обтюрацией или разрывом церебральных сосудов (при гипертензиях, атеросклерозе, тромбоэмболиях, артериовенозных мальформациях и т. д.). Большая медико-социальная значимость проблемы цереброваскулярной патологии определяется высоким удельным весом сосудистых заболеваний мозга в структуре заболеваемости и смертности населения, высокими показателями временной нетрудоспособности и первичной инвалидности. В группе острых нарушений мозгового кровообращения, выделяют транзиторную ишемию головного мозга и инсульт.
Морфология транзиторной ишемии головного мозга представлена сосудистыми расстройствами (спазм артериол, плазматическое пропитывание их стенок, периваскулярный отек и единичные мелкие геморрагии) и очаговыми изменениями мозговой ткани (отек, дистрофические изменения нейронов). Эти изменения обратимы; на месте бывших мелких геморрагий могут определяться периваскулярные отложения гемосидерина.
Инсультом называют остро (внезапно) развивающееся локальное расстройство мозгового кровообращения, которое сопровождается повреждением вещества мозга и нарушениями его функции. Различают: геморрагический и ишемический инсульт. Морфологически геморрагический инсульт это гематома или геморрагическое пропитывание вещества мозга (в том числе и субарахноидальное кровоизлияние. 80% субарахноидальных кровоизлияний возникает вследствие разрыва аневризмы сосудов основания мозга. 10% спонтанных внутричерепных кровоизлияний обусловлены артериовенозными мальформациями (АВМ) (рис.2).

Эти очаги сложной врожденной патологии сосудов головного мозга ранее назывались "ангиомами" или "артериовенозными аневризмами". АВМ могут иметь клиновидную или грибовидную форму (широкая часть к коре, узкая к основанию мозга), разные размеры (микро- до 0,5 см, малые 1-2 см, средние 2-4 см, большие 4-6 см, гигантские >6 см), локализацию (интра-, экстра церебральные и смешанные). Выделение АВМ очень важно, так как при своевременной диагностике их можно оперировать.
При гематомах мозга которые наблюдаются при большинстве (около 85%) геморрагических инсультов, чаще всего находят разрушение стенок артериол и мелких артерий с образованием микроаневризм и их разрывом. В месте кровоизлияния ткань мозга разрушается, образуется полость, заполненная свертками крови и размягченной тканью мозга (красное размягчение мозга) (рис. 3).
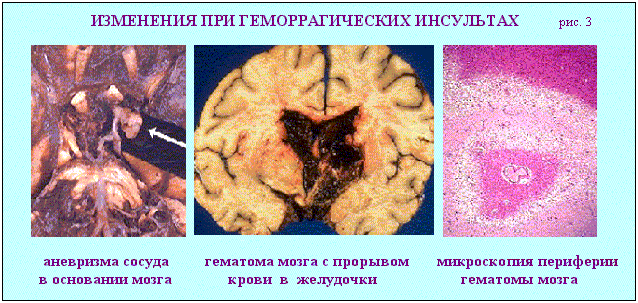
Кровоизлияния локализуется чаще всего в подкорковых узлах головного мозга (зрительный бугор, внутренняя капсула) и мозжечке. Гематомы с прорывом крови в желудочки мозга всегда заканчиваются смертью. Если больной переживает инсульт, то по периферии кровоизлияния в ткани мозга появляется много сидерофагов, зернистых шаров, клеток глии и свертки крови рассасываются. На месте гематомы образуется киста с ржавыми стенками и буроватым содержимым.
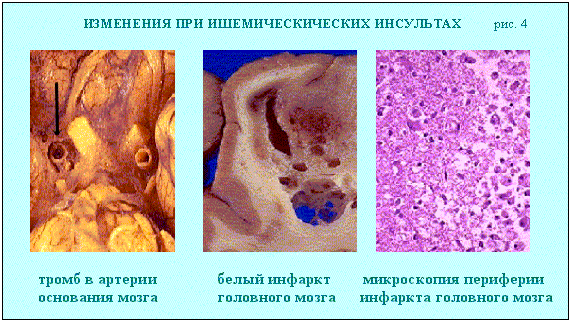
Mорфологическим выражением ишемического инсульта является инфаркт (серое размягчение мозга). Наиболее часто ишемический инсульт наблюдается у лиц в возрасте от 50 до 60 лет и старше. Примерно в половине случаев мозгового инфаркта, наблюдающегося при атеросклерозе, важную роль в механизме его развития играют стенозы и тромбозы экстракраниальных отделов сонных и позвоночных артерий. В некоторых случаях инфаркт возникает не в зоне наиболее пораженного магистрального сосуда, а в другом бассейне в связи с неадекватным перераспределением крови и реализацией так называемого синдрома обкрадывания (характерно для АВМ). Причинами инфаркта мозга в молодом возрасте являются артерио-венозные мальформации, кардиогенные эмболии мозговых сосудов
вследствие митральной болезни (стеноз митрального клапана) или пролапса митрального клапана.
Развивающиеся инфаркты при ишемическом инсульте чаще всего локализуются в бассейне средней мозговой артерии с вовлечением коры головного мозга. Различают белые (или серые), красные и смешанные инфаркты мозга; чаще встречаются белые инфаркты. При микроскопическом исследовании среды некротических масс можно обнаружить погибшие нейроны. Осложнения ишемических инсультов (инфарктов мозга), как и их последствий (кисты мозга) - параличи.
6 - Кардиомиопатии-определение,отличия в морфологии трех вариантов болезни
КАРДИОМИОПАТИИ - некоронарогенные и неревматические дистрофические поражения миокарда проявляющиеся в недостаточности его сократительной функции. Предположение о наличии кардиомиопатии должно возникнуть при наличии синдрома воспалительных, дистрофических и дегенеративных изменений в миокарде, если при этом:
а) не удается выявить какой-либо этиологический фактор болезни;
б) нет признаков воспалительного процесса в организме;
в) наблюдается выраженная торпидность признаков сердечной недостаточности;
г) сердечная недостаточность по типу застоя в верхней полой вене и воротной вене;
д) наличие кардиомегалии;
е) тромбоэмболические осложнения.
Кардиомиопатии(КМП) принято разделять на:
1-дилатационную,
2- гипертрофическую,
3 - рестриктивную.
Дилатационная КМП характеризуется расширением всех полостей сердца, которое шаровидно Характерна для хрониченского алкоголизма и конечных стадий вирусных миокардитов. (рис 6-1, 6-4).
Гипертрофическая кардиомиопатия (ГКМП) — это редкое заболевание сердечной мышцы, характеризующееся выраженной гипертрофией миокарда левого желудочка при отсутствии этиологических факторов увеличения массы сердца (прежде всего артериальной гипертонии и аортального стеноза). Частота ГКМП в популяции составляет около 0,2%. ГКМП считают наследственным заболеванием, которое передается по аутосомно-доминантному типу- чаще всего проявляется утолщением задней стенки левого желудочка и/или межжелудочковой перегородки с развитием идиопатического субаортального стеноза (рис 5-2,56-5).. Необходимо учитывать, что у больных ГКМП нередко наблюдается симметричная гипертрофия ограниченного участка миокарда левого желудочка. Если толщина стенки левого желудочка превышает 20 мм, то диагноз ГКМП не вызывает сомнений. Сложнее установить диагноз при пограничной гипертрофии миокарда, когда толщина стенки составляет 13-15 мм, а признаки обструкции левого желудочка отсутствуют. В подобных случаях диагностическое значение могут иметь результаты генетического исследования
Рестриктивная КМП по одним данным связана с болезнями протекающими с фиброзом эндокарда.(рис 5-3, 5-6).. По другим данным этот вид КМП чаще всего связан с амилоидозом (рис 5-6).

Рекомендуемая дополнительная литература:
1. В. И. Шмырев, Н. В. Миронов Применение новых медицинских технологий в клинической неврологии "Кремлевская медицина. Клинический вестник" № 4 ОКТЯБРЬ - ДЕКАБРЬ 1998г.
2. Н. А. Зорин Артериовенозные мальформации головного мозга Клинический вестник" № 4 ОКТЯБРЬ - ДЕКАБРЬ 1998г.
|
Дата добавления: 2014-01-06; Просмотров: 323; Нарушение авторских прав?; Мы поможем в написании вашей работы!