
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы технологии изготовления люминофоров
|
|
|
|
О химических реакциях в твердой фазе. Получение люминофоров связано с прохождением твёрдофазных реакций (обычно при повышенных температурах) в смеси компонентов (шихты) - при этом одновременно идёт и синтез основания и люминофорный синтез. Температура синтеза близка к точке твёрдофазных превращений, так как при этом скорость реакций между компонентами резко увеличивается (эффект Хедвала).
Правило для синтеза основания - если для него применяются компоненты, один из которых обладает высоким поглощением энергии, возбуждающей люминесценцию, то этот компонент следует брать в недостаточном количестве - чтобы обеспечить его полное отсутствие в полученном основании.
Скорость протекания твёрдофазных реакций определяется скоростью диффузии вступающих в реакцию ионов. Диффузия при более низких температурах идёт по линейным дефектам структуры - дислокациям, а при более высоких Т, используемых при синтезе оснований из окислов, по точечным дефектам - вакантным узлам решетки и междуузлиям. Не исключается некоторое взаимодействие компонентов уже при размоле шихты, когда концентрация дислокаций увеличивается. По мере взаимодействия дислокаций с примесями появляется скопление примесей в районе дислокаций, откуда может начаться диффузии примесей в объём, может также протекать реакция с образованием нового материала и разрушением материнского кристалла. При этом опять появятся дислокации и реакция будет углубляться. Окончательное превращение исходных продуктов в основное вещество определяется объёмной диффузией, скорость которой становится достаточно большой при Т >Тпл. Появление вакансий в твёрдом теле связано с влиянием конфигурационной энтропии (энтропии смешения), которая определяется числом различных способов распределения атомов по имеющимся узлам решетки.
При синтезе люминофоров идёт рост кристаллов, а при одновременном синтезе люминофора и люминофорного основания образуются смешанные кристаллы, рост которых определяется объёмной диффузией и зависит от времени прокалки. Эти люминофоры выдерживают последующее механическое измельчение без ухудшения люминесцентных свойств. Наоборот, такие цинк-сульфидные люминофоры, как ZnS:Cu, ZnS:Ag обладают сильным трибогашением (выделение в отдельную фазу сульфидов Cu и Ag). Средний линейный размер зерна и распределение зёрен по линейному размеру (грансостав) зависит от времени и температуры (действует более эффективно) прокалки. Для ZnS-люминофоров важно получить нужную гранулометрию (средняя величина зёрен ~ 8мкм) уже при синтезе (!), чтобы его не размалывать. Для регулирования роста кристаллов (особенно ZnS-люминофоров) в шихту добавляются плавни (хлористые соединения - NaCl, MgCl2) - их действие зависит от состава основания (соотношения температур плавления и кипения).
С точки зрения химического синтеза люминофоры разделяются на 2 группы: 1) регулярные - имеют высокие значения концентраций активаторов (от десятых до единиц %); 2) полупроводниковые - (п/п) (обладают полупроводниковыми свойствами) - они имеют концентрации 10-2-10-3 %. Наиболее важными регулярными люминофорами являются люминофоры, активированные Mn (ион Mn2+). Взаимодействие этого иона с решеткой зависит от её состава, поэтому максимум полосы излучения Mn может быть в различных зонах спектра: формула основания-цвет-длина волны максимума полосы (BeF2∙CaF2- синий- 470нм; CaF2∙AlF3- зелёный - 525нм; BaF2∙
∙ZnF2- красный; MgSiO3- красный - 675нм).
Особенности п/п люминофоров: 1) очень малая концентрация активаторов (10-2÷10-3%); 2) трудность введения активатора при отсутствии коактиватора (добавка при синтезе); 3) плавная зависимость Iλ активаторной полосы от химического состава основания; 4) резкое уменьшение эффективности свечения при механическом разрушении кристаллов (трибогашение). Коактиватор - соединение, не образующее иона, общего с основанием (неактивный ион, который способствует повышенной растворимости активатора в сульфиде): ZnS:Cu - повышенной растворимостью в ZnS обладает CuCl. Основания п/п люминофоров образуются из элементов II, VI групп периодической таблицы Д.И.Менделеева (ZnS, CdS, ZnSe, CdSe), активаторами являются элементы I и V групп, коактиваторами - элементы III и VII групп. Например, для ZnS: активаторы группы I, входящие в кристалл вместо элемента группы II, должны создать в кристалле акцепторные уровни, на которых может локализоваться электрон, если он берётся из валентной зоны, то появляется положительно заряженная дырка, т.е. ZnS:Cu - дырочный п/п.
Образование центров свечения (ЦС) в люминофорах ZnS: 1) На активных участках частичек ZnS адсорбируются соединения, позволяющие получить молекулу ZnCl2, активными участками являются выходы дислокаций; 2) При повышении Т начинается диффузия ZnCl2 по дислокациям вглубь кристалла с последующим образованием безактиваторных ЦС; 3) Вслед за ZnCl2 диффундируют сульфиды активаторов, которые образуют активаторные ЦС; 4) Рост кристаллов идёт вместе с образованием ЦС. К повышению яркости свечения приводит минерализующее действие плавня, а также участие его в структуре ЦС - таким образом можно изготавливать мелкозернистые высокоэффективные ZnS-люминофоры.
Предварительная обработка ZnS и получение ZnS с 1 активатором (Cu, Ag) и 1 коактиватором (Cl) - LаCl3, NaCl, CaCl2, NH4Cl: 1) ZnS + + 2NaCl → прокалка → ZnCl2 + Na2S; 2) (ZnS)n∙ ZnCl2 + Cu2S → 200oC → → (ZnS)n+1 ∙ 2CuCl → 900oC → (ZnS)nCu2S + ZnCl2 → при диффузии ZnCl2 вглубь кристалла по дислокациям образуются ЦС (VZnClS)- (λ = 460нм).
Изменение основания люминофоров приводит к изменению ширины запрещённой зоны (ШЗЗ): при переходе от ZnS (3,7 эВ) к CdS (2,4 эВ), к ZnSe (2,7 эВ), к CdSe (1,75 эВ), при увеличении ШЗЗ уменьшается λмак полосы излучения. В ZnS∙ZnSe:Ag λмак ↑ c 450 нм до 580 нм при ↑ ZnSe от 0 до 80%, а в ZnS∙ZnCd:Ag,Cl λмак ↑ от 450 нм до 600 нм при ↑ ZnCd от 0 до70% [5].
Основные правила изготовления и обработки люминофоров в лабораторных и промышленных условиях: 1) Высокая чистота и управляемость технологии по материалам, которые могут быть активаторами (тяжелые металлы); 2) Специальные помещения, исключающие производство других химических работ, исключение запылённости (потолок и стены должны быть покрыты масляной краской), защита препаратов и сосудов колпаками (от пыли), воздух (приточный) должен очищаться фильтрами и иметь избыточное давление в помещении, все сосуды для реактивов должны быть чистыми (кипячение а азотной кислоте), бумажные и металлические фильтры и сита не применять (только стеклянные, шелковые и капроновые), применять платиновые или кварцевые тигли, лодочки из окиси бериллия и агатовые ступки, все сосуды - из химически стойкого стекла и т.д.; 3) Химикаты: а) химикаты марок «хч» и «чда» в большинстве случаев должны подвергаться дополнительной очистке от примесей тяжелых металлов, методы очистки приведены [1, т.3], б) все применяемые нормальные реактивы (вода, кислоты, органические жидкости) для приготовления суспензий должны дважды дистиллироваться; 4) Прокалочные печи и прокалочная среда: Смесь реактивов основания и активаторов приобретает способность к люминесценции после кристаллизации в процессе прокалки (при этом активатор диффундирует в материал основы). Прокалка проводится при 700÷1200оС (в некоторых случаях до 1500оС). Применяются электрические печи сопротивления из керамических материалов, кварцевого стекла, окиси бериллия, и др., при этом они должны допускать точную регулировку температуры и длительности прокалки. Печи иногда имеют системы для удаления летучих паров металлов, чтобы постепенно печь не загрязнялась. В промышленных электрических печах конвейерного типа для транспортирования шихты используются кюветы из кварца или бериллия. Иногда в печи или в кюветах требуется создание инертной среды; 5) Мельницы и шары, применяемые для измельчения спечённой массы, делаются из химически чистых материалов с большой прочностью на истирание (специальные марки керамики или кварца).
Требования к люминофорам, работающим в высоком вакууме и в разрядных лампах: 1) низкое давление паров и хорошая обезгаживаемость; 2) химическая и механическая устойчивость к последующей обработке; 3) требуемый цвет свечения; 4) высокая световая отдача; 5) требуемая длительность свечения; 6) малая чувствительность к изменению температуры; 7) максимальная эффективность при заданной температуре; 8) длительный срок службы в эксплуатационных условиях; 9) для электроннолучевых приборов - пропорциональность L = φ (јЭТ), где L - яркость экрана, јЭТ - плотность тока в электронном пучке. Более подробно о требованиях к люминофорному слою, порошку люминофора и отдельным частицам люминофора см. в [6,7].
Принципиальная технологическая схема синтеза люминофоров: 1) приготовление чистых исходных материалов; 2) дозирование и смешивание исходных материалов; 3) добавление активаторов или веществ - солей, содержащих активаторы; 4) процесс активации путём прокалки; 5) процессы измельчения и подготовки его для приготовления суспензии.
Особенности синтеза галофосфата кальция, активированного Sb и Mn (ГФК: Sb и Mn - 3Ca3(PO4)2 Ca(F,Cl)2: Sb,Mn). Преимущества ГФК: 1) менее чувствителен к примесям, чем другие люминофоры; 2) исходные материалы имеют низкую стоимость по сравнению с ранее применяемыми (силикат цинка-бериллия - ZnBeSiO4:Mn и вольфрамат магния - 1WO3+2MgO); 3) в противоположность люминофорам, содержащим Be, ГФК не имеет токсического действия (без Cd); 4) ГФК обладает большой стабильностью в условиях ртутного разряда. Основные свойства ГФК и других люминофоров для ЛЛ рассмотрены в [6,7], а более подробно в [11]. ГФК - разновидность апатита: М10(ХО4)Y2, где М - положительный двухвалентный ион (Ca, Pb, Mn); ХО4 - группа РО4, VO4; Y - ион галоида (F,Cl) или ОН. Кристалл имеет гексагональную симметрию.
Технология изготовления ГФК фирмы Gen.El.Co. (по Brit. Pat. 578192, 1942): 1) Исходные материалы: CaСO3, CaCl2, CaF2, Sb2O3, MnCl2 или их соединения, из которых они образуются при прокалке; 2) Получение ортофосфата Са - Са3(РО4)2: 600 г СаСО3 чистейшего + 250 г фосфорной кислоты (Н3РО4) - 90%-ой чистейшей, растворённой в 550 см3 дистиллированной (дист.) Н2О → соединение → после вспенивания: фильтрование, промывка дист Н2О, сушка при 160оС и размол в кварцевой шаровой мельнице до получения мелкозернистого порошка → выход: 600г Са3(РО4)2; 3) Получение фосфорно-кислого Mn (MnHPO4∙3H2O): а) 396г фосфата аммония - (NH4)2HPO4 + 2л дист. Н2О → раствор А; б) 594г хлористого Mn (MnCl2∙4H2O) + 3л дист. Н2О → раствор Б; в) добавить 10см3 раствора А к раствору Б → фильтрование; г) добавить 10см3 раствора Б к раствору А → фильтрование; д) смешать оба профильтрованных раствора → фильтровать, промыть кипящей дист Н2О, просушить при 160оС, размолоть в шаровой мельнице до получения мелкодисперсного порошка → выход: около 550г MnHPO4∙3H2O; 4) Смешивание компонент в молярном соотношении в соответствии с формулой: 3Са3(РО4)2∙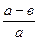 СаCl2∙
СаCl2∙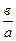 СаF2: 3%Sb: (0,5
СаF2: 3%Sb: (0,5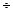 5%)Mn и таблицей
5%)Mn и таблицей
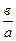 
|  Основание Основание
|      Содержание Mn при содержании Sb 3% 0 0,5 1 2 5 Содержание Mn при содержании Sb 3% 0 0,5 1 2 5
| ||||
| 1/1 | 3Cа3(РО4)2 1CaF2 | Светло- Голубовато- Желтовато- Светло- Жел - белый белый белый желтый тый | ||||
| 3/4 | 3Cа3(РО4)2 3/4СаF2 1/4СаСl2 | Светло- Беловатый Кремово- Желтовато- Оран- синий белый оранжевый жевый | ||||
| 1/2 | 3Cа3(РО4)2 1/2СаF2 1/2СаСl2 | Светло- Беловатый Кремово- Светло- Оран- синий белый оранжевый жевый | ||||
| 1/4 | 3Cа3(РО4)2 1/4СаF2 3/4СаСl2 | Светло- синий | Беловатый Розово- белый | Оранжевый | Розово- красный | |
| 3Cа3(РО4)2 1CaCl2 | Зелёно- синий | Беловатый | Розово- белый | Розовый | Красный | |
для получения желаемого спектра; 5) Размол полученной смеси; 6) Прокалка в закрытых лодочках из SiO2 (по 300 г) в электрической печи при 1060оС в течение 1часа в неокислительной атмосфере; 7) Охлаждение в вытяжном шкафу; 8) Размол до получения частиц размером 1÷5 мкм.
Промышленная технология изготовления ГФК (обзор всех технологий, разработанных в СССР и РФ - по люминофорам Л-34, ЛГ-1, ЛГ1-К, ЛГ-1-2, ЛГ-1-3, ФЛ-580-3500-1, ФЛ-580-3500-2, ФЛ-580-3500-3 приведён в [11]. Шихта для люминофора Л-34: CaHPO4 - 261,4г; CaCO3 - 78,8г; CaF2 - 21,6г; SrCl2 - 13,6г; Sb2O3 - 14,0г; MnCO3 - 10,0г. Шихта люминофора ФЛ-580-3500-2 (в масс.%): CaHPO4∙ Sb2O3 - 67,8; (Ca, Mn, Cd)∙(CO3,∙F2) - 29,3; NH4Cl - 2,6; AlPO4 - 0,1; уголь «БАУ» - 0,2. Шихта люминофора ФЛ-580-3500-3 (без Cd) (в масс.%): CaHPO4 - 64,37; CaCO3 - 21,95; MnCO3 - 2,69; CaF2 - 5,819; NH4Cl - 1,84; Sb2O3 - 3,32; Pr6O11 - 0,011.
Режим термической обработки шихты ГФК: а) быстрое ↑ Т до 800÷850оС для проведения энергичного разложения CaHPO4 с удалением паров Н2О продуванием горячих газов; б) выдержка при 1000÷1200оС в течение времени, необходимого для внедрения активаторов и удаления структурных дефектов из кристаллического основания; в) быстрое охлаждение продукта для сохранения преимуществ фторапатитной структуры кристаллов; г) во избежание окисления Mn прокалку необходимо вести в закрытых объёмах (исключается доступ кислорода).
Плёнки SbCl3 и Sb2O3, оседающие на поверхности люминофора очень вредны, поэтому в технологии имеются меры по их удалению путём промывки (после измельчения) растворами кислот (разбавленные минеральные или органические кислоты) - они не стравливают люминофор, а переводят Sb в комплексы, например, 2%-й раствор лимонной кислоты).
Химические реакции при синтезе ГФК: 1) получение CaHPO4 (дикальцийфосфата) из водных растворов (осаждение безводного продукта необходимо проводить при Т > 60оС): (NH4)2HPO4 + CaCl2 + 2H2O = = CaHPO4∙2H2O ↓ + 2NH4Cl; 2) образование пирофосфата Ca (ПФК): 2CaHPO4 → 380÷500оС → Ca2P2O5 + H2O; 3) образование ортофосфата Ca (ОФК): Ca2P2O5 → 800÷900oC → Ca3(PO4)2; 4) образование основания ГФК: 3Ca3(PO4)2 + CaF2(CaCl2) → 1150oC → 3Ca3(PO4)2∙ CaF2(CaCl2); 5) 3СaCl2 + Sb2O3 → 600oC → 2 SbCl3 + CaO → SbCl3 частично улетучивается при Т > 700оС, остальная часть растворяется во фторапатите; 6) диффузия Sb и Mn в кристаллическую решетку заканчивается при 950÷1000оС.
Синтез оксидных люминофоров, активированных Eu: YVO4:Eu; Y2O3:Eu; Gd2O3: Eu. YVO4:Eu получают спеканием чистейших окислов при 1000÷1100оС или же прокалкой осаждённого ванадата иттрия и европия с последующим размолом и вторичной прокалкой. Осаждение проводят в сильнощелочной среде – получается мелкодисперсный продукт. Y2O3:Eu и Gd2O3: Eu получают спеканием осаждённых оксалатов (при осаждении вводят пергидроль). Оба люминофора обладают сильной фотолюминесценцией с ηкв~ 1. Характеристики люминофоров см. ниже.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2369; Нарушение авторских прав?; Мы поможем в написании вашей работы!