
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомогенные каталитические реакции.
|
|
|
|
Наиболее распространены в жидкой и газовой фазах.
В жидкой фазе: распад Н2О2 под действием Мn+, гидролиз и омыления сложных эфиров в присутствии ионов водорода Н+.
В газовой фазе: распад диэтилового эфира под действием I2.
1) некаталитическая реакция:
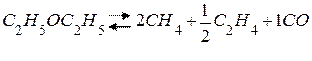 |
2) каталитическая реакция:

Механизм реакции:
І стадия: обратимый процесс образования промежуточных веществ.

ІІ стадия: лимитирующая стадия превращения промежуточных веществ с образованием конечных продуктов и регенерации kat.


Рассмотрим кинетику протекание гомогенных каталитических реакций с точки зрения ТАК.
Стадийный механизм гомогенного катализа
Некаталитическая реакция:

Каталитическая реакция протекает в три стадии:
І стадия: обратимая стадия образования промежуточного вещества между одним из исходных веществ А и kat – K.
 промежуточное в-во
промежуточное в-во
ІІ стадия: образование активного комплекса между промежуточным веществом АК и вторым исходным веществом В.
 активный комплекс
активный комплекс
ІІІ стадия: распад активного комплекса с образованием конечных продуктов и восстановлением катализатора:

Рассмотрим профиль пути каталитической и некаталитической реакции.
|


Рис. Профиль пути каталитической гомогенной реакции по стадийному механизму.
Еа(некат.) – энергия активации некаталитической реакции;
∆Н(р-ции) – энтальпия активации реакции;
-∆НАК – энтальпия образования промежуточного продукта (реакция экзотермическая, тогда только возможно ускорение реакции);
Еа(кат.) – энергия активации каталитической реакции;
∆Е=Еа(некат.)- Еа(кат.) – снижение энергии активации каталитической реакции по сравнению с некаталитической.
Наличие ∆Е возможно за счет вхождения К в состав АК.
Пусть


Т.к. ∆Е в степени, то даже незаметное снижение Еа вызывает сильное ускорение реакции.
 , тогда
, тогда 
Однако, существуют процессы, которые в принципе невозможны без kat.
Выведем уравнение для 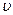 гомогенной каталитической реакции по накоплению продукта С.
гомогенной каталитической реакции по накоплению продукта С.

По принципу Боденштейна:
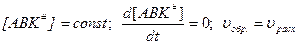
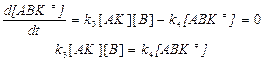
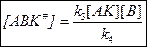
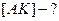 По принципу Боденштейна:
По принципу Боденштейна:

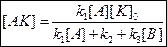


1) Если равновесие І стадии смещено в сторону образования исходных веществ.
k2>>k1, тогда k1[A]<<k2 из этого следует k1[A] – пренебрегаем.
Концентрация [AK] – мала; 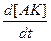 - мало, [AK] – близка к равновесной.
- мало, [AK] – близка к равновесной.
Т.к. [AK] мала, то k3<<k2, значит k3[B] – пренебрегаем.

Реакция имеет второй порядок по исходным веществам, 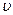 пропорциональна концентрации исходных веществ А и В и концентрации kat – K.
пропорциональна концентрации исходных веществ А и В и концентрации kat – K.
Если равновесие І стадии сдвинуть в сторону образования исходных веществ, то концентрация промежуточного вещества АК мала и близка к равновесной. Такое вещество называется промежуточным веществом Аррениуса.
2) Если равновесие ІІ стадии сдвинуть в сторону образования промежуточного вещества АК.
k1>>k2, тогда k2 – пренебрегаем.
Концентрация AК – велика и является неравновесной. Образующееся вещество АК мгновенно расходуется по (3) реакции.
Тогда k1<<k3, значит k1[А] – пренебрегаем.
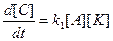
Реакция имеет первый порядок по веществу А, 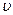 пропорциональна концентрации А и К.
пропорциональна концентрации А и К.
Если равновесие І стадии сдвинуть в сторону образования промежуточного продукта, то его концентрация увеличивается и далека от равновесной. Такое вещество называется промежуточным веществом Вант-Гоффа.
По стадийному механизму промежуточные вещества образуются на каждой стадии.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 561; Нарушение авторских прав?; Мы поможем в написании вашей работы!