
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетерогенные химические реакции. Кинетическая и диффузионная области протекания гетерогенного процесса
|
|
|
|
Гетерогенный катализ – это катализ, при котором катализатор находится в одной фазе, а реагирующие вещества – в другой, при этом реакция идет на границе раздела фаз.
На практике наиболее часто встречается два вида гетерогенного катализа:
1)процессы, катализатор которых находится в твердой фазе, а реагирующие вещества – в жидкой;
2) процессы, катализатор которых находится в твердой фазе, а реагирующие вещества – в газе.
Реакция происходит на поверхности твердого тела – катализатора, где происходит соприкосновение двух фаз: твердое тело – газ или твердое тело - жидкость.
Гетерогенный процесс можно разделить на пять стадий:
1) транспорт (диффузия) реагирующих веществ к поверхности катализатора;
2) адсорбция реагирующих веществ на поверхности катализатора;
3) реакция на поверхности катализатора;
4) десорбция продуктов реакции с освобождением поверхности катализатора;
5) транспорт (диффузия) продуктов реакции в объёме.
Следует отметить, что в зависимости от условий лимитирующей стадией может быть любая.
Скорость гетерогенного процесса определяется как количество вещества, реагирующего в единицу времени на единице площади поверхности:
 ,
,
где S – площадь поверхности, где протекает реакция.
Подвод реагентов к поверхности и отвод продуктов осуществляется за счет молекулярной или конвективной диффузии.
Диффузия – это перемещение молекул вещества в неподвижной фазе под действием градиента концентрации.
Закон Фика для диффузии в заданном направлении имеет вид:
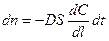
где dn – количество вещества, проходящего за время dt через поверхность S; D – коэффициент диффузии; dC/dl – градиент концентрации; dC – разность концентраций; dl – толщина диффузионного слоя.
Пусть на границе раздела фаз концентрация реагирующего вещества равна Сs, а на некотором расстоянии δ – Сх (при этом Сs < Сх), тогда
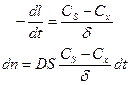
Разделим правую и левую часть на V и перейдем к концентрациям:
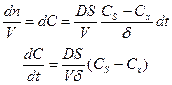
Скорость диффузии кинетически подчиняется уравнению первого порядка относительно концентрации раствора в объёме (Сх). Таким образом, если лимитирующей стадией является диффузия, то кинетика реакции определяется данным уравнением. В таком случае говорят, что процесс протекает в диффузионной области.
Если скорость химической реакции значительно меньше, чем скорость диффузии, процесс проходит в кинетической области и описывается уравнением той реакции, которая протекает на поверхности.
При сравнимых скоростях диффузии и реакции процесс проходит в переходной области.
Константу скорости в зависимости от температуры можно выразить уравнением:
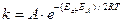 ,
,
где Еа – энергия активации химической реакции, ЕД – энергия активации диффузии.
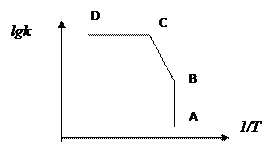
Величина ЕД (5-10 кДж/моль), т.е. ЕД <<Еа (поэтому экспериментальная энергия активации приблизительно в 2 раза меньше, чем истинная энергия активации химической реакции). Поскольку энергия ЕД невелика, то при повышении температуры, скорость диффузии будет расти медленнее, чем скорость химической реакции (при изменении температуры на 10°С скорость диффузии изменится в 1,1,-1,2 раза, а скорость химической реакции – в 2-4 раза). Поэтому в широком диапазоне температур наблюдается сложный характер зависимости ln k от 1/Т.
- при низких Т реакция протекает в кинетической области СД, скорость реакции сильно зависит от Т;
- при высоких Т скорость диффузии обычно значительно меньше скорости химической реакции и процесс проходит в диффузионной области АВ со скоростью, которая мало изменяется.
- отрезок ВС соответствует переходной области, когда скорости диффузии и химической реакции на поверхности соизмеримы.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3141; Нарушение авторских прав?; Мы поможем в написании вашей работы!