
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некаталитические методы
|
|
|
|
Некаталитические методы не отличаются высокой чувствительностью, но они селективны, позволяют определять в смеси близкие по свойствам вещества без их предварительного разделения. Например, два сходных по химическим свойствам соединения А и В реагируют с одним и тем же реагентом R, образуя продукты Р1, и Р2, но реакция с участием вещества А идет гораздо быстрее, имеет гораздо большую константу скорости (к1 > к2). Для того чтобы определить один из компонентов смеси с достаточной точностью, необходимо относительно большое различие в константах скорости реакций этих компонентов с одним и тем же реагентом. Добиться этого можно, изменяя pH или температуру системы, подбирая соответствующие растворители и т.д. Если к1/к2> 500, то в начальный период реакции можно определять вещество А на фоне вещества В с погрешностью менее 1 %. Если же константы скоростей реакций реагента с близкими по свойствам компонентами смеси мало отличаются друг от друга, что не позволяет пренебречь какой-либо из реакций, используют специальные расчетные методы. Так, еще в 1930 г. в США был предложен остроумный и достаточно точный способ раздельного определения изомеров бутена, основанный на различной скорости взаимодействия продуктов их бромирования с иодидом калия. Некаталитические кинетические методы применяют для анализа смесей органических соединений (спиртов, сахаров, аминов), а также для анализа смесей близких по свойствам ионов металлов (щелочноземельных или редкоземельных элементов).
Каталитические методы
Каталитические методы анализа (в отличие от некаталитических) характеризуются высокой чувствительностью. Представим кинетическое уравнение каталитической реакции в следующем виде:
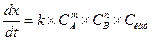
и преобразуем его в выражение

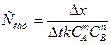
Из уравнения видно, что снизить Скат можно следующими способами:
· обеспечить снижение Δх; чтобы регистрировать очень малые изменения концентрации индикаторного вещества, нужно использовать наиболее чувствительные способы измерения концентрации;
· увеличить время Δt наблюдения за протеканием индикаторной реакции;
· использовать оптимальные (как правило, высокие) концентрации реагентов А и В.
Наиболее эффективным приемом повышения чувствительности каталитических методов является увеличение константы скорости k каталитической реакции за счет введения активаторов, оптимизации pH раствора, повышения температуры, проведения процесса в водно-органических средах.
Реальную чувствительность каталитических методов ограничивает протекание
(наряду с каталитической) некаталитической реакции, обусловленной наличием различных примесей в реактивах и воде или другом растворителе. Все это создает «фон», колебания которого ограничивают предел обнаружения катализатора. Уменьшить влияние фона можно, используя реактивы и растворители высокой степени чистоты.
Варьируя условия проведения реакции (концентрации реагентов, pH, природу растворителя), используя активаторы и маскирующие вещества, можно добиться того, что катализатором в индикаторной реакции будет только одно соединение — определяемый компонент. Однако обеспечить это удается не всегда. Каталитические методы используют для определения микроколичеств металлов, прежде всего первого переходного ряда и группы платиновых металлов, а также для определения некоторых анионов (I-, С1-, Вг-, S2-). Органические вещества, особенно токсичные и лекарственные препараты, определяют как по их собственному каталитическому действию в индикаторных реакциях, так и по их ингибирующему или активирующему действию на ион металла-катализатора. Кинетические методы используют в анализе биологических объектов и объектов окружающей среды, в клиническом анализе, а в некоторых случаях — и в заводских лабораториях.
Биохимические методы анализа
Ферментативные методы. Среди каталитических методов наиболее высокой чувствительностью и селективностью обладают ферментативные методы, основанные на использовании реакций, катализируемых ферментами — биологическими катализаторами, ускоряющими химические процессы в живых организмах и вне их. Эти методы стали применять в аналитических лабораториях в 1970-е гг. С их помощью можно определять сами ферменты, субстраты — соединения, превращения которых катализируют ферменты, а также эффекторы (активаторы или ингибиторы) — соединения, воздействующие на каталитическую активность ферментов.
Ферменты обладают уникальными свойствами, которые отличают их от дру гих катализаторов:
· Прежде всего, это — необычайно высокая каталитическая активность. Добавка незначительного количества (10 -9— 10 -7 моль/л) фермента иногда ускоряет превращение субстрата в 108—1012 раз.
· Другое важное свойство — специфичность действия фермента в отношении структуры субстрата, типа индикаторной реакции и условий ее проведения. Специфичность фермента — это прежде всего его способность ускорять превращение только одного типа субстратов (например, одноатомных спиртов), а иногда — только какого-либо одного субстрата. Так, фермент уреаза катализирует только гидролиз мочевины. Вместе с тем эффективно влияет на скорость этой индикаторной реакции только уреаза. Специфичность взаимодействия в паре фермент — субстрат, неоднократно сопоставляемая со специфичностью пары ключ —замок, обусловлена сложной структурой и весьма сложным механизмом действия фермента.
Ферменты — сложные белковые молекулы, представляющие собой высокомолекулярные соединения, состоящие из a-L-аминокислот. связанных друг с другом пептидными (амидными) связями. Белковая часть фермента (апофермент) может быть связана с небелковыми компонентами (кофакторами); такой комплекс называют холоферментом. Основной частью фермента, определяющей его каталитические свойства, является активный центр — участок белковой молекулы, на котором происходит превращение субстрата (рис.). Иногда в активном центре фермента выделяют участок, связывающий субстрат, и каталитический участок, содержащий каталитически активные группы белка (кофакторы). Часто эти участки совпадают. Как правило, активный центр находится в углублении («кармане») белковой глобулы, размерам и форме которого должна соответствовать молекула субстрата. Для многих ферментов характерно наличие регуляторных участков, которые взаимодействуют с веществами, влияющими на активность фермента, т. е. активаторами или ингибиторами.
Ингибитор

Активатор
Механизм действия ферментов включает сорбцию субстрата на активном центре фермента и образование активного комплекса (фермент — субстрат) в результате гидрофобных, полярных и ионных взаимодействий. В этом комплексе происходит сближение и ориентация реагирующих групп фермента и субстрата. Взаимодействие между ферментом и сорбированным субстратом носит полифункциональный характер, при котором молекула субстрата подвергается атаке сразу нескольких каталитических групп активного центра фермента, что и обусловливает его высокую каталитическую активность.
Скорость реакций с участием ферментов можно измерять разными способами. Чаще всего применяют фотометрические методы. При этом в качестве индикаторных используют катализируемые пероксидазой и другими оксидазами (ферментами, катализирующими окислительно-восстановительные реакции), а также гидролазами (катализирующими реакции гидролиза) реакции образования окрашенных продуктов. Исключительно высокой чувствительностью отличаются хемилюминесцентные методы контроля ферментативных реакций. Контролировать скорость биохимических реакций, протекающих с поглощением или выделением протонов, а также окислительно-восстановительных процессов, сопровождающихся поглощением кислорода или обрзованием пероксида водорода, удобно электрохимическими методами (потенциометрия, амперометрия и т.д.)
Ферментативные методы находят широкое применение в анализе самых разнообразных объектов — медицинских (биологических жидкостей, тканей живых организмов), пищевых продуктов, фармацевтических препаратов; для непрерывного контроля микробиологических и биохимических процессов в производстве. Эти методы используют и для определения токсичных органических и неорганических соединений в объектах окружающей среды, особенно в природных водах.
Иммунохимические методы. К биохимическим методам кроме ферментативных относят также иммунохимические методы. Напомним, что генетически чужеродные вещества, попадая в организм высших животных и человека, способны вызывать ряд специфических процессов, направленных на удаление этих веществ из организма. Система, регулирующая эти специфические процессы, называется иммунной, а сами процессы — иммунологическими. Вещества, способные вызывать специфические иммунологические реакции в организме, в том те биосинтез специфических антител, называют антигенами. К антигенам относятся, в частности, белки, полисахариды, нуклеиновые кислоты. Важнейший иммунологический процесс – образование сецифических белков крови –антител (иммуноглобулинов). Биологическая функция антител состоит в защите организма от чужеродных веществ (антигенов) путем их распознавания, специфического связывания в прочные иммунные комплексы и удаления их из организма. Таким образом иммунохимические методы анализа основаны на специфическом связывании определяемого соединения – антигена соответствующими антителами. Иммунохимическая реакция представлят собой сложный процесс, протекающий в несколько стадий. Классические методы иммунохимического анализа основаны на образовании осадка при взаимодействии антител с антигенами. За протеканием этого процесса обычно наблюдают визуально и обнаруживают или полуколичественноопределяют относительно высокие концентрации компонентов. Эти методы длительны и трудоемки.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 924; Нарушение авторских прав?; Мы поможем в написании вашей работы!