
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники тока, их основные виды и характеристики
|
|
|
|
Лекция 2.5.
Тема: Прикладные аспекты электрохимии.
План: 1. Химические источники тока, их основные виды и характеристики.
2. Коррозия металлов и методы защиты.
3. Полярография.
Химические источники тока делятся на два вида:
1) источники тока одноразового действия – гальванические элементы;
2) источники тока многоразового действия – аккумуляторы.
Аккумуляторы – это элементы, у которых при пропускании тока от внешнего источника (в обратном направлении) происходят химические изменения на электродах и в растворе, в результате чего работа электрического тока запасается в форме свободной энергии продуктов реакции. Такой процесс называется заряжением. Заряженный аккумулятор отдает электрический ток в процессе разряжения, после чего может быть вновь заряжен.
В промышленности и производстве наиболее распространены свинцовый, щелочной кадмиево-никелевый аккумуляторы, топливные элементы.
Более современные аккумуляторы используются в электронике и радиотехнике: никель-металлгидридные, литий-ионные, литий-полимерные.
Свинцовый аккумулятор в заряженном состоянии представляет собой элемент
(-) Pb, PbSO4 (т) | H2SO4 (32 – 34 %), aq | PbO2 (т), Pb (+)
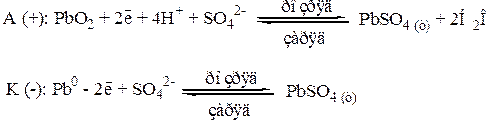
 |

При работе аккумулятора в процессе его разряжения происходит уменьшения концентрации H2SO4 и накопления твердой соли PbSO4. При зарядке элемента концентрация H2SO4 увеличивается.
Э.д.с. свинцового аккумулятора: 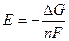

Химический потенциал твердых веществ (чистых) при данной Т и р:
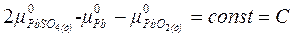

n = 2;

Е0
|
Э.д.с. свинцового аккумулятора зависит от концентрации H2SO4.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 325; Нарушение авторских прав?; Мы поможем в написании вашей работы!
