
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ингибирование ферментативной активности
|
|
|
|
Это снижение каталитической активности фермента под действием ингибиторов. Ингибиторы ферментов принято делить на 2 класса: обратимые и необратимые. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определенных условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
1. конкурентное ингибирование – это обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор – структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат или фермент-ингибитор. Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназной реакции малоновой кислотой. Сукцинат связывается с активным центром фермента сукцинатдегидрогеназы. В ходе ферментативной реакции происходит отщепление двух атомов водорода от сукцината и присоединение их к коферменту ФАД. В результате образуется фумарат, который высвобождается из активного центра сукцинатдегидрогеназы. Малоновая кислота – структурный аналог сукцината и может также взаимодействовать с активным центром сукцинатдегидрогеназы. При этом химическая реакция не идет.
Многие лекарственные препараты оказывают свое терапевтическое действие по механизму конкурентного ингибирования. Например, аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибитора активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечной дистрофии. Эффективные ацетилхолинэстеразные препараты – прозерин, эндрофоний.
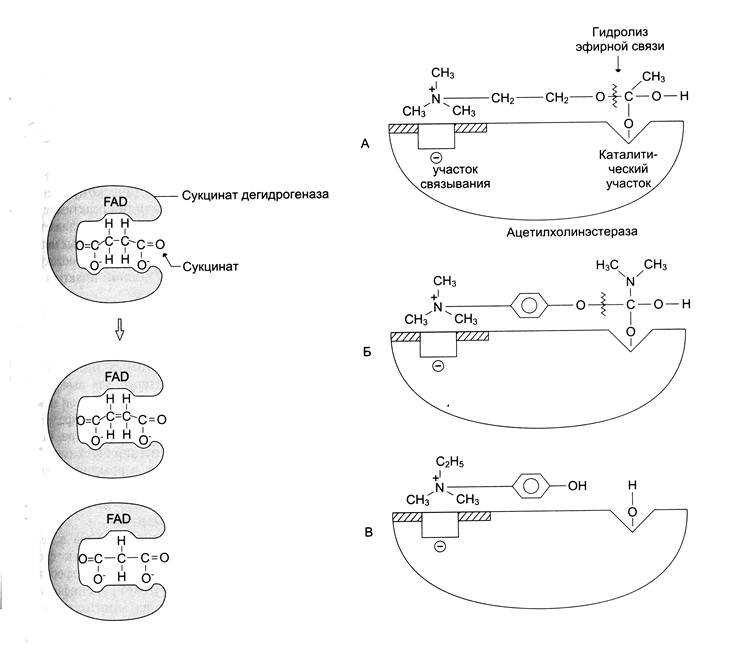 А. присоединение ацетилхолина в активном центре фермента.
А. присоединение ацетилхолина в активном центре фермента.
Б. присоединение конкурентного ингибитора – прозерина в активном центре фермента.
В. присоединение конкурентного ингибитора – эндрофония в активном центре фермента. Эндрофоний связывается в активном центре ацетилхолинэстеразы, препятствуя присоединению ацетилхолина.
2. неконкурентное ингибирование – ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентный ингибитор связывается либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким об разом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Необратимое ингибирование наблюдается в случае образования ковалентных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента. В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжелых металлов (ртути, серебра, мышьяка), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению.
Специфические и неспецифические ингибиторы
Специфические ингибиторы блокируют определенные группы активного центра фермента. Например, диизопропилфторфосфат (ДФФ) специфически реагирует лишь с одним из многих остатков серина в активном центре фермента. ДФФ относят к специфическим необратимым ингибиторам «сериновых» ферментов, так как он образует ковалентную связь с гидроксильной группой серина, находящегося в активном центре.
Ацетат йода легко вступает в реакции с SH-группами остатков цистеина любых белков, поэтому его относят к неспецифическим ингибиторам.
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов – аспирин.
Ферменты могут быть простыми или сложными белками. Если фермент сложный белок, то его небелковую часть называют кофактором или коферментом, а белковую часть – апоферментом. Апофермент с коферментом образует активную форму катализатора – холофермент
 апофермент + кофактор (кофермент) холофермент
апофермент + кофактор (кофермент) холофермент
Взаимодействие субстрата с ферментом происходит в центре связывания (активном центре) и сопровождается образованием множественных связей между ними.
Кофакторы ферментов
1. ионы металлов (цинк, магний, железо, медь). Металл может являться частью активного центра фермента и участвовать в катализе. Он может быть связующим звеном между ферментом и субстратом, может проявлять координирующее свойство, благодаря которому субстрат оказывается в активном центре фермента
2. органические соединения с низкой молекулярной массой, обладающие способностью обратимо связываться с апоферментом (НАД+-никотинамидадениндинуклеотид, НАДФ+-никотинамидадениндинуклеотидфос-
фат, коэнзим А)
3. простетические группы – прочно присоединенные к апоферменту (ФАД-флавинадениндинуклекотид, ФМН-флавинмононуклеотид)
Коферменты принимают участие в связывании и превращении субстратов, поэтому в его отсутствие фермент теряет свою каталитическую активность.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1772; Нарушение авторских прав?; Мы поможем в написании вашей работы!