
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства растворов
|
|
|
|
Занятие № 10. Основы процессов выпаривания
ЛЕКЦИЯ
по учебной дисциплине "Тепло-массообменное оборудование предприятий"
(к учебному плану 200__г)
Разработал: к.т.н., доцент Костылева Е.Е.
Обсуждена на заседании кафедры
протокол № _____
от "_____" ___________2008 г.
Казань - 2008 г.
Занятие № 10. Основы процессов выпаривания
Учебные цели:
1. Рассмотреть основы физико-химических процессов выпаривания.
2. Изучить конструкции, принцип действия испарительных и опреснительных установок.
Вид занятия: лекция
Время проведения: 2 часа
Место проведения: ауд. ________
Литература:
1. Тепломассообмен: Учебное пособие для вузов / Ф.Ф. Цветков, Б.А. Григорьев. - 3-е издание. М.: Издательский дом МЭИ, 2006. - 550 с.
2. Выпарные и кристаллизационные установки: Учеб. пособие / Конахин А.М., Конахина И.А. и др. - Казань: Казан. гос. энерг. ун-т, 2006.- 194 с.
Учебно-материальное обеспечение:
Плакаты, иллюстрирующие учебный материал.
Структура лекции и расчет времени:
| № п/п | Структура занятия | Время, мин. |
| 1. 2. 3. | Повторение пройденного материала на лекции №9 Учебные вопросы: 1. Свойства растворов. 2. Физико-химические и термодинамические основы процессов выпаривания. 3. Испарительные, опреснительные установки. Принцип действия, основные конструкции аппаратов, тепловые схемы. Заключение |
Под концентрацией раствора b понимается отношение массы сухого вещества Gc,, кг, содержащегося в растворе, к общей массе раствора. Она может выражаться в процентах или относительных величинах.
b= , (1.1)
, (1.1)
где W – количество растворителя в растворе, кг.
Растворителями могут быть вода, спирты, органические жидкости и т.д. В технике чаще всего имеют дело с водными растворами солей.
Для большинства растворов в определенном количестве воды или другого растворителя нельзя растворить неограниченное количество твердого вещества. Раствор, содержащий при данных условиях предельное количество растворенного вещества, называется насыщенным [1].
Количество растворенного вещества в насыщенном растворе, отнесенное к определенному количеству раствора или растворителя, называется растворимостью (табл. 1.1). Растворимость твердых веществ в воде не является постоянной величиной, а изменяется в значительных пределах в зависимости от температуры. Для большинства солей растворимость в воде с повышением температуры растет; для некоторых солей она понижается (CaCrO4, MnSO4, NaSO4 и др.), и избыток соли выпадает в виде кристаллов. У поваренной соли NaCI растворимость от температуры практически не зависит [1].
Присутствие кристаллов в растворе при выпаривании нежелательно, так как они осаждаются на стенках аппарата и поверхностях нагрева кипятильников и образуют слой накипи или осадка, которые снижают теплопередачу и ухудшают работу выпарных аппаратов.
Таблица 1.1. Растворимость некоторых веществ в воде при температуре 20 оС
| Вещество | Растворимость в воде г/100 г H2О | Концентрации насыщенного раствора, % | Вещество | Растворимость в воде г/100 г H2О | Концентрации насыщенного раствора, % |
| NaCI | 35,8 | 26,4 | BaSO4 | 0,00023 | 0,00023 |
| КCI | 34,2 | 25,5 | Mg(OH)2 | 0,001 | 0,001 |
| Na2СO3 | 21,2 | 17,6 | CaCO3 | 0,0014 | 0,0014 |
| NaOН | 107,0 | 51,7 | Ca(OH)2 | 0,16 | 0,16 |
| ВаCI | 35,6 | 26,3 | NaSO4 | 32,8 | 24,7 |
| СаSO4 | 0,2 | 0,2 | MgCI2 | 35,3 | 26,1 |
Процесс выпаривания характерен значительным изменением физико-химических свойств растворов, связанных с изменением его концентрации.
С повышением концентрации увеличиваются плотность и вязкость, понижаются удельная теплоемкость, теплопроводность и интенсивность теплоотдачи, изменяется теплота растворения [1].
Плотность раствора можно легко определить по правилу аддитивности, зная его концентрацию и плотности чистых компонентов при данной температуре:
 , (1.2)
, (1.2)
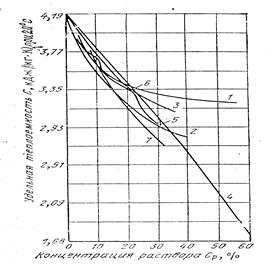
где  - плотность безводного нелетучего вещества, кг/м3;
- плотность безводного нелетучего вещества, кг/м3; 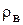 - плотность растворителя (воды), кг/ м3.
- плотность растворителя (воды), кг/ м3.
Все жидкие растворы обладают вязкостью, характерной для данного раствора. Вязкость всех растворов существенно зависит от температуры, уменьшаясь с ее повышением.
Численные значения динамической и кинематической вязкости растворов даются в справочной и специальной литературе. Изменение вязкости в зависимости от концентрации для некоторых растворов приведено
 |
на рис. 1.2.
Рис.1.2. Изменение массовой удельной теплоемкости водных растворов в зависимости от концентрации раствора при 20 оС:
1 – NaOH; 2 – KOH; 3 – (NH4)2SO4; 4 – NaNO2; 5 – NH4NO3; 6 – K2CO3; 7 – CACI2
Удельную теплоемкость раствора с р, кДж/(кг·К), приближенно можно определить также по правилу аддитивности:
с р= с с b + с в(1- b), (1.3)
где с с – удельная теплоемкость безводного нелетучего вещества в растворе (табл. 1.2); с в – удельная теплоемкость воды при 20 оС.
Таблица 1.2. Удельная теплоемкость сухих (безводных) веществ
| Вещество | с сух, кДж/(кг· К) |
| С3Н8О3 | 2.41 |
| С5Н10О5 | 1.29 |
| СаСI2 | 0.687 |
| KCI | 0.676 |
| KNO3 | 0.965 |
| NaCI | 0.837 |
| NaNO3 | 1.089 |
| NH4NO3 | 1.37 |
| (NH4)2SO4 | 1.42 |
| NH4CI | 1.52 |
Удельную теплоемкость химического соединения при отсутствии данных можно ориентировочно рассчитать по уравнению:
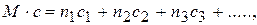 (1.4)
(1.4)
где 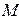 - молекулярная масса химического соединения; с – его массовая удельная теплоемкость, Дж/(кг ·К); п 1, п 2, п 3 … - число атомов элементов, входящих в соединение; с 1, с 2, с 3, … - атомные теплоемкости, Дж/(кг·атом·К), приведенные в табл.1.3.
- молекулярная масса химического соединения; с – его массовая удельная теплоемкость, Дж/(кг ·К); п 1, п 2, п 3 … - число атомов элементов, входящих в соединение; с 1, с 2, с 3, … - атомные теплоемкости, Дж/(кг·атом·К), приведенные в табл.1.3.
Таблица 1.3. Атомная теплоемкость
| Элемент | Атомная теплоемкость | Элемент | Атомная теплоемкость, Дж/ с·кг | ||
| В твердом состоянии | В жидком состоянии | В твердом состоянии | В жидком состоянии | ||
| С | 7,5 | 11,7 | F | 20,95 | 29,3 |
| H | 9,6 | P | 22,6 | ||
| B | 11,3 | 19,7 | S | 22,6 | |
| Si | 15,9 | 24,3 | остальные | 33,5 | |
| O | 16,8 | 25,1 |
Удельные теплоемкости некоторых веществ приведены в табл.1.2. Удельная теплоемкость раствора зависит не только от концентрации растворенного вещества, но и от температуры. Для многих растворов удельная теплоемкость не подчиняется правилу аддитивности и не может быть достаточно точно вычислена по формуле (1.3). Отклонение от правила аддитивности тем больше, чем больше концентрация растворенного вещества (рис.1.2). Поэтому в точных расчетах целесообразно использовать опытные значения удельной теплоемкости растворов, приводимые в виде таблиц или номограмм.
Теплопроводность растворов  за редким исключением с ростом концентрации растворенного вещества уменьшается (рис. 1.3).
за редким исключением с ростом концентрации растворенного вещества уменьшается (рис. 1.3).
Теплопроводность воды и водных растворов электролитов в интервале от 20 до 100 оС различаются незначительно. Поэтому зависимость теплопроводности водных растворов солей и щелочей от температуры может быть принята такой же, как и для воды:
 (1.5)
(1.5)
Для воды 
При растворении твердых веществ в воде наблюдается охлаждение раствора, так как разрушается кристаллическая решетка, а на это требуется затрата энергии. Теплота растворения зависит от природы вещества и растворителя, а также от концентрации раствора.

Рис.1.3. Изменение теплопроводности водных растворов солей в зависимости от концентрации раствора при 20 оС:
1 – КОН; 2 – КСI; 3 – КNО3; 4 – К2СО3; 5 – MgCI2; 6 – MgSO4; 7 – NaCI; 8 – NaNO3; 9 – NaSO4; 10 – Na2CO3; 11 – NaOH; 12 – CaCI2
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 917; Нарушение авторских прав?; Мы поможем в написании вашей работы!