
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение бензола
|
|
|
|
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1865 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряжёнными связями (чередуются простые и двойные связи) – циклогексатриен-1,3,5:

Такая структура молекулы бензола не объясняла многие свойства бензола:
1) Для бензола характерны реакции замещения, а не присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов.
2) Бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором KMnO4).
Чтобы выйти из этого затруднения, Кекуле был вынужден допустить возможность постоянного изменения положения двойных связей в молекуле бензола, т.е. выдвинул теорию "осцилляции«, согласно которой двойные связи не фиксированы на одном месте:

Проведённые позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С-С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 1200. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp2-гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:

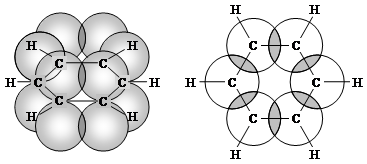
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизированные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряжённая π-система (рис. 2).
 |
а) б)
Рис.2. Взаимное перекрывание 2 р -орбиталей в молекуле бензола:
а – вид сбоку; б – вид сверху
В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит «выравнивание» простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи. Равномерное распределение π-электронной плотности между всеми углеродными атомами, обусловленное π-электронным сопряжением, и является причиной высокой устойчивости молекулы бензола.
В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Практически это и невозможно сделать. Но чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к помощи следующих формул:
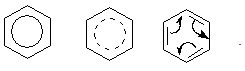
Таким образом, по современным данным все связи между атомами углерода в кольце бензола одинаковы и по длине занимают промежуточное положение между одинарными и двойными. Однако в конденсированных аренах не все межатомные связи в кольце сохраняют равнозначность, вследствие чего для них применяется более общее изображение с тремя двойными связями.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 575; Нарушение авторских прав?; Мы поможем в написании вашей работы!