
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Иодометрия
|
|
|
|
Метод основан на полуреакции:
I2 + 2e→ 2I¯ ( В).
В).
Реакция обратима, ее направление зависит от условий. Иод плохо растворим в воде, но в присутствии иодид-ионов образуется комплекс I3¯, поэтому при титровании протекает реакция:
I3¯ + 2e→ 3I¯ ( В).
В).
I2 – окислитель средней силы, I¯ – средней силы восстановитель, поэтому в иодометрии применяют окислительные свойства иода и восстановительные свойства иодидов. Иодометрия является универсальным методом и применяется для определения и восстановителей, и окислителей.
Условия иодометрического титрования.
¨ Титруют в нейтральной, кислой или слабощелочной средах; рН ≤ 9, так как в щелочной среде образуется гипоиодид:
I2 + 2ОН¯→ IO¯+ I¯ + Н2О.
Гипоиодид – сильный окислитель, окисление титранта приводит к завышенным результатам титрования. Поэтому анализируемый раствор подкисляют серной кислотой.
¨ Титрование проводят на холоде, так как I2 – летучее соединение; кроме того, при повышенной температуре понижается чувствительность индикатора.
¨ Реакция между определяемым веществом и иодидом калия протекает во времени, поэтому выделившийся в результате реакции иод титруют спустя 5–7 мин.
¨ Вследствие плохой растворимости I2 в воде при определении окислителей добавляют избыток КI. Выделившийся в результате реакции замещения иод хорошо растворяется в растворе КI. Кроме того, избыток иодида калия способствует ускорению реакции в требуемом направлении.
¨ Реакция замещения протекает в затемненном месте, без доступа воздуха, так как свет ускоряет окисление I¯ кислородом воздуха до I2, это приводит к завышенным результатам титрования.
¨ Высокая точность титрования обусловлена применением специфического чувствительного индикатора – крахмала; раствор крахмала должен быть свежеприготовленным.
Амилоза, входящая в состав крахмала, образует с иодом адсорбционно-комплексное соединение, окрашенное в синий цвет. Прочность комплекса зависит от концентрации иода в растворе: чем она выше, тем устойчивее комплекс.
Особенность применения крахмала как индикатора заключается в том, что его добавляют в конце титрования, когда концентрация иода в пробе мала, и раствор имеет соломенно-желтую окраску. В присутствии крахмала раствор приобретает синюю окраску, титрование продолжают до обесцвечивания раствора.
Если крахмал добавить в начале титрования, когда концентрация иода в растворе высока, образуется прочный комплекс, для разрушения которого требуется избыток титранта, при этом пробу перетитровывают.
Иодометрическое определение восстановителей выполняют методом прямого титрования. Титрант – раствор иода, который готовят растворением точной навески смеси I2 с КI (I2 + КI → КI3) в дистиллированной воде высокой степени очистки. Приготовленный раствор хранят в склянке из темного стекла во избежание окисления иодида и улетучивания иода.
Прямым иодометрическим титрованием определяют As3+, As5+ (после предварительного восстановления), Sn2+, Hg2+ и другие металлы.
Индикатор – крахмал, который добавляют в начале титрования, точку эквивалентности фиксируют по появлению синего окрашивания раствора от избыточной капли раствора иода.
Иодометрическое определение окислителей выполняют методом замещения по следующей схеме.
1. В колбу для титрования помещают избыток раствора КI, раствор подкисляют серной кислотой и добавляют анализируемый раствор окислителя.
Колбу с реакционной смесью накрывают часовым стеклом и помещают на 5 мин в затемненное место. При этом протекает реакция замещения, в результате образуется эквивалентное количество I2.
2. Окрашенный в бурый цвет раствор иода титруют раствором тиосульфата натрия; индикатор – крахмал, который добавляют в конце титрования.
Препарат Na2S2O3·5Н2О не относится к стандартным веществам, так как может не соответствовать своей химической формуле (кристаллизационная вода при хранении выветривается) и разрушаться ферментными тиобактериями. Кроме того, раствор тиосульфата натрия неустойчив при хранении, подвержен автоокислению. Поэтому готовят рабочий раствор, точную концентрацию которого устанавливают при титровании стандартного раствора дихромата калия.
Титр рабочего раствора тиосульфата натрия устанавливают методом замещения, так как прямое титрование невозможно вследствие нестехиометричности реакции тиосульфата натрия с дихроматом калия. Определение проводят в присутствии серной кислоты и избытка иодида калия. При этом известное количество К2Cr2O7 замещается на эквивалентное количество иода:
К2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4К2SO4 + 7Н2О.
 |
Cr2O72– + 14Н+ + 6е → 2Cr3+ + 7Н2О 1
2 I¯– 2е → I2 3
––––––––––––––––––––––––––––––––––––––––––
Cr2O72– + 14Н+ + 6I¯→ 2Cr3+ + 3I2 + 7Н2О.
Выделившийся в результате реакции иод оттитровывают раствором тиосульфата натрия:
I2 + 2Na2S2O3 → 2 NaI + Na2S4O6.
 I2 + 2e → 2I¯ 1
I2 + 2e → 2I¯ 1
2S2O32– – 2е → S4O62– 1
–––––––––––––––––––––––––––––-
I2 + 2S2O32– → 2I¯ + S4O62–.
Молярная концентрация эквивалента:
 ;
;
.
КОМПЛЕКСОМЕТРИЯ
Комплексометрия – титриметрический метод анализа, основанный на взаимодействии металлов с моно- или полидентатными лигандами с образованием комплексных соединений. Для решения аналитических задач в комплексометрии в качестве титрантов применяют, как правило, полидентатные органические реагенты, так как только при этом можно получить четкий скачок на кривой титрования и зафиксировать точку эквивалентности.
Метод титрования с применением полидентатных органических реагентов (комплексонов) называется комплексонометрией.
Начало применению комплексонов как аналитических реагентов положил швейцарский химик Г.Шварценбах (1945 г.). Комплексоны относятся к классу полиаминополикарбоновых кислот. Эти соединения называются "хелатоны" (США), "трилоны" (Германия), "комплексоны" (Россия).
Наибольшее распространение и применение в анализе среди комплексонов получили комплексон II (ЭДТУ) – этилендиаминтетрауксусная кислота
НООС –Н2С СН2 –СООН
 N–СН2 –СН2– N
N–СН2 –СН2– N
НООС –Н2С СН2 –СООН
и хорошо растворимая в воде двунатриевая соль этилендиаминтетрауксусной кислоты – комплексон III (ЭДТА)
 НООС–Н2С СН2 –СООNa
НООС–Н2С СН2 –СООNa
N–СН2–СН2– N
NaООС–Н2С СН2 –СООН
Лиганд комплексонов обычно обозначают Y (с соответствующим зарядом и степенью протонирования):
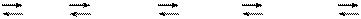 Н6Y 2+ Н5Y + Н3Y – Н2Y 2– НY 3– Y 4–
Н6Y 2+ Н5Y + Н3Y – Н2Y 2– НY 3– Y 4–
рН: 0 1 2 3 – 6 6 –10 10–14
ЭДТУ (Н4Y) – белое кристаллическое вещество, малорастворимое в воде (2 г/дм3, 22 ОС), раствор бесцветен. Дигидрат Na2Н2Y ·2Н2О (ЭДТА) – белый кристаллический препарат, относительно хорошо растворим в воде (108 г/дм3, 22 ОС).
Особенности строения комплексонов:
¨ Наличие в молекулах комплексонов нескольких групп кислотного характера (–СООН), атомы водорода которых способны замещаться на металл. При этом образуется валентная связь.
¨ Присутствие двух атомов азота, имеющих неподеленную пару электронов и, следовательно, способных образовывать координационные связи с металлом.
¨ Шесть функциональных групп с донорными атомами азота и кислорода позволяют комплексонам реагировать со всеми металлами, кроме металлов со степенью окисления 1, образуя комплексные соединения – комплексонаты.
Реакция комплексообразования протекает мгновенно, практически необратима.

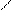 НООС–Н2С СН2 –СООNa
НООС–Н2С СН2 –СООNa

 Мe3+ + N–СН2 –СН2– N →
Мe3+ + N–СН2 –СН2– N →
NaООС–Н2С СН2 –СООН

 ООС–Н2С СН2 –СОО
ООС–Н2С СН2 –СОО
→ N–СН2 –СН2– N +2Н+ +Na+
NaООС–Н2С СН2 –СОО
Мe
Свойства комплексонатов.
¨ Комплексонаты – прочные соединения, слабые электролиты. Их прочность обусловлена наличием в молекуле двух видов связи (валентной и координационной) и замкнутых циклов, разветвленных в пространстве. Состояние комплексонатов в растворе характеризуется константой устойчивости (β).
 МеY 2– Ме2+ + Н2Y 2–
МеY 2– Ме2+ + Н2Y 2–
β =
¨ Чем выше степень окисления металла, тем устойчивее комплексонат и, следовательно, выше константа устойчивости.
¨ Независимо от степени окисления металла, комплексонаты характеризуются одинаковым составом 1:1. Ступенчатое комплексообразование отсутствует. Поэтому эквиваленты металлов, как и комплексонов, равны 1.
¨ Комплексонаты хорошо растворимы в воде, растворы их бесцветны.
Условия комплексонометрического титрования.
1. Реакция комплексообразования сопровождается изменением рН вследствие накопления протонов:
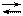 Ме2+ + Н2Y 2– МеY 2– + 2Н+.
Ме2+ + Н2Y 2– МеY 2– + 2Н+.
Изменение рН влияет на устойчивость комплексонатов: с увеличением рН устойчивость комплексонатов повышается. Поэтому Ме2+ определяют в щелочной или нейтральной среде, Ме3+ и Ме4+ – в кислой среде. При выборе условий титрования раствора соли определенного металла необходимо учитывать константу β, которая прямо зависит от рН.
Растворы, содержащие Mg2+, Са2+, Ва2+, титруют при рН = 9 – 10 в присутствии аммонийной буферной смеси.
| Ион | β | рН | Буферный раствор |
| Mg2+ | 109 | 9–10 | Аммонийный |
| Ca2+ | 1011 | ||
| Fe2+ | 1014 | 5–7 | |
| Zn2+ | 1016 | ||
| Sn2+ | 1018 | Ацетатный, фосфатный | |
| Cu2+ | 1019 | ||
| Fe3+ | 1024 | 2–3 | |
| Bi 3+ | 1027 | – | |
| Th4+ | 1025 | ||
| Zr4+ | 1030 |
Особенность комплексонометрического титрования состоит в том, что в одной пробе без предварительного разделения можно раздельно определять катионы различных металлов, варьируя условия с помощью буферных растворов. Несколько металлов в растворе можно определять при условии, если константы устойчивости их комплексонатов отличаются более, чем на четыре порядка (β1/ β2≥104). При этом для титрования раствора соли каждого катиона должен быть свой индикатор.
2. Фиксирование точки эквивалентности. Для визуального фиксирования точки эквивалентности в комплексонометрии применяются металлоиндикаторы – органические соединения, изменение окраски которых зависит от концентрации ионов металла в растворе. Металлоиндикаторы с ионами титруемого металла образуют окрашенные комплексы.
Требования к металлоиндикаторам.
¨ Индикатор должен образовывать достаточно устойчивый комплекс с ионами металла в соотношении Меn+ : Ind = 1:1.
¨ Комплексное соединение металла с индикатором должно быть менее прочным, чем комплексонат данного металла:
β (МеInd) << β(МеY2–).
¨ Комплекс МеInd должен быть кинетически подвижным и быстро разрушаться при действии комплексона III.
¨ Окраска комплекса МеInd должна отличаться от собственной окраски металлоиндикатора. Переход окраски должен быть контрастным.
Металлоиндикаторы, как правило, являются многоосновными кислотами и в зависимости от рН могут существовать в различных формах, окраска которых зависит от реакции среды. Интервал перехода окраски индикатора рассчитывают по уравнению:
∆pMe = lg β(МеInd) ± 1.
Наибольшее применение в анализе среди металлоиндикаторов получил эриохромовый черный Т. Он образует комплексные соединения с ионами Са2+, Mg2+, Zn2+, Pb2+ и другими красного или фиолетового цвета.
Индикатор в зависимости от рН изменяет форму и окраску:
 Н3Ind Н2Ind– Н Ind 2– Ind 3–
Н3Ind Н2Ind– Н Ind 2– Ind 3–
винно-красная синяя оранжевая
рН 0 – 6 6 –11 11–14
Механизм изменения окраски эриохромового черного Т в слабощелочной среде состоит в следующем.
¨ К анализируемой пробе, содержащей ионы определяемого металла, добавляют индикатор. При этом раствор приобретает винно-красную окраску вследствие образования комплекса металла с индикатором:
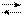 Mg2+ + НInd 2– [MgInd]– + Н+ (связывается основанием
Mg2+ + НInd 2– [MgInd]– + Н+ (связывается основанием
синяя винно-красная аммонийного буферного раствора)
¨ Окрашенный раствор титруют раствором комплексона III. Комплекс [MgInd]– разрушается вследствие образования комплексоната магния. Окраска раствора в точке эквивалентности становится синей благодаря выделению индикатора в свободном виде:
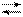 [MgInd]– + НY 3– [MgY]2– + НInd 2–.
[MgInd]– + НY 3– [MgY]2– + НInd 2–.
винно-красная синяя
Кривая комплексонометрического титрования
Способы комплексонометрического титрования.
1. Прямое титрование. Применяется для определения содержания солей металлов в пищевых продуктах, питьевой, природной и сточной воде промышленных предприятий, в почвах. Надежный способ определения жесткости воды. Титрант – раствор комплексона III.
2. Обратное титрование. Применяется для определения солей металлов, когда трудно подобрать индикатор или при медленном взаимодействии ионов металла с титрантом. К анализируемому раствору добавляют избыток титрованного раствора комплексона III, не вступивший в реакцию остаток ЭДТА титруют раствором MgSO4. Определяют Сd2+; Zn2+ Al3+ Fe3+; Sn4+
3. Косвенное титрование. Применяется для определения анионов (SO42–; РO43–; С2O42– и другие). Анионы из раствора осаждают титрованным раствором соли металла, избыток которого затем оттитровывают раствором комплексона. Раствор комплексона III готовят по точной навеске в мерной посуде, но концентрацию раствора необходимо уточнять (препарат Na2Н2Y·2Н2О гигроскопичен, массовая доля влаги до 0,3 % влаги). Стандартные вещества метода – MgSO4, СаСО3, ZnCl2.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1857; Нарушение авторских прав?; Мы поможем в написании вашей работы!