
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярные и неполярные молекулы
|
|
|
|
Орбиталей. Пространственная конфигурация молекул.
Направленность ковалентной связи. Гибридизация атомных
Ковалентной связи
Донорно-акцепторный механизм образования
Кроме рассмотренного обменного механизма образования ковалентной связи, существует и другой механизм, когда образование ковалентной связи происходит при взаимодействии одного атома или иона с заполненной атомной орбиталью с другим атомом или ионом, имеющим вакантную орбиталь. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Атом или ион, поставляющий электронную пару, называется донором, а атом или нон, ее принимающий, называется акцептором.
По донорно-акцепторному механизму происходит перекрывание вакантной орбитали акцептора с заполненной орбиталью донора или донорной группы.
Таким образом, валентность атомов элементов определяется как числом связей, образованных по обменному механизму, так и числом связей, образованных по донорно-акцепторному механизму.
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи:
s-связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов (рис.1.):
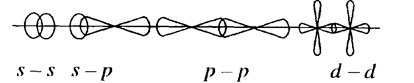
Рис. 1
p связь возникает при перекрывании атомных орбиталей в плоскости, перпендикулярной оси, соединяющей ядра атомов (риc. 2):
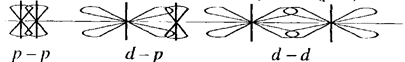
Рис. 2
Таким образом,.s-электроны участвуют лишь в образовании s-связи; р - и d-электроны – в образовании s- и p -связей.
При наложении p -связи на s -связь образуются кратные связи - двойные и тройные.
Число связей между атомами называется кратностью или порядком связи.
С увеличением кратности связи длина связи уменьшается, а прочность ее возрастает.
Гибридизация (смешение) атомных орбиталей возникает тогда, когда в образовании химической связи участвуют электроны разных подуровней, поскольку они отличаются и энергией связи, и характером (прочностью и направленностью) образуемых связей.
В результате гибридизации электронных облаков разного типа происходит образование гибридных орбиталей, число которых определяется числом смешиваемых электронных облаков (рис. 3).
Рис. 3
Перекрывание в случае гибридных орбиталей будет больше, чем в случае чистых орбиталей, поэтому при образовании химической связи будет выделяться больше энергии, а образовавшаяся связь будет прочнее.
При смешении одной s-орбитали и одной p-орбитали образуются две гибридные орбитали, и такой тип гибридизации называется sp - гибридизацией. Угол между гибридными орбиталями составляет 1800 (рис. 4).
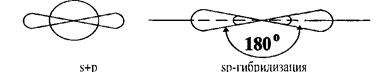
Рис. 4
При смещении одной s- и двух p-орбиталей образуются три гибридные орбитали (sp2-гu6puдuзация); угол между ними равен 120° (рис. 5).
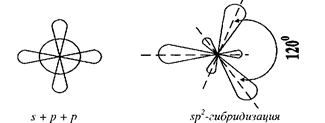
Рис. 5
Взаимодействие одной s и трех p -орбиталей сопровождается sp3-гu6puдuзацией, при которой угол между гибридными орбиталями ранен 1090 28' (рис. 6)
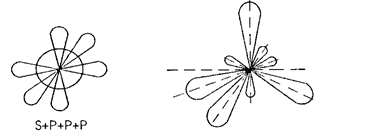
Рис. 6
Направленность химических связей определяет пространственную конфигурацию молекул. Если в состав молекулы входят два атома и перекрывание их атомных орбиталей происходит вдоль линии, соединяющей ядра атомов, то форма такой молекулы является линейной, а связи в молекуле расположены под углом 180. Такую же форму имеет молекула в случае sp -гибридизации орбиталей (рис 7).

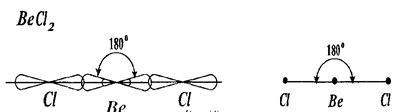
Рис. 7
В случае sp2 -гибридизации молекула (ВСl3) имеет форму правильного треугольника, в котором угол между связями составляет 120° (рис. 8).
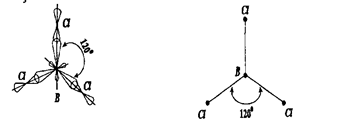
Рис. 8
В случае sp 3 - гибридизации форма молекулы (ССl4) является тетраэдрической; угол между связями равен 1090 28' (рис. 9).
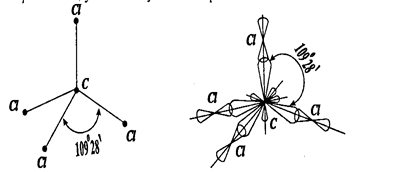
Рис. 9
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 383; Нарушение авторских прав?; Мы поможем в написании вашей работы!