
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодический закон Д.И. Менделеева
|
|
|
|
В зависимости от того, на какой энергетический подуровень пришёл последний электрон, различают электронные семейства элементов (s, p, d, и f элементы).
1. s - элементы, это элементы первой группы главной подгруппы и второй группы главной подгруппы (IA, IIA). На внешнем энергетическом уровне у них 1 или 2 электрона. Все s - элементы - типичные металлы (исключение - Be - амфотерный).
В своих соединениях s - элементы имеют степени окисления +1 и +2.
IA - щелочные металлы, их оксиды обладают основным характером.
Пример: Na2O + H2O = NaOH - щёлочь.
IIА - Be -амфотерный металл, Mg – типичный металл. Их оксиды не реагируют с водой, гидроксиды не растворимы в воде. Ca, Sr, Ba - щелочноземельные элементы. Их оксиды непосредственно реагируют с водой, обладают основным характером.
Пример: CaO + H2O = Ca(OH)2
Пример: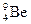 : 1s22s2; n = 1,2; IIA.
: 1s22s2; n = 1,2; IIA.

Be° Be*
Бериллий в основном состоянии не имеет неспаренных электронов, но при поглощении кванта энергии спаренные s-электроны распариваются и занимают свободные ячейки на p-подуровне. Таким образом, в возбужденном состоянии атом бериллия имеет валентность, равную 2.
Валентность элемента равна количеству неспаренных электронов в возбужденном состоянии.
2. p - элементы, это элементы c третьей группы главной подгруппы по восьмую группу главной подгруппы (IIIA - VIIIA), в основном – это неметаллы. Они занимают верхний правый угол в таблице Менделеева:
Неметаллы могут проявлять как положительные, так и отрицательные степени окисления: отрицательную степень окисления - в соединениях с водородом и металлами.
Минимальная степень окисления равна (№ группы-8): C-4 H4, N-3H3, H2S-2, HCl-1.
В соединениях с кислородом и с другими более электроотрицательными элементами, неметаллы могут проявлять положительную степень окисления, максимальная степень окисления равна номеру группы.
Пример:
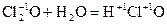 - хлорноватистая кислота;
- хлорноватистая кислота;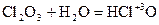 2 - хлористая кислота;
2 - хлористая кислота;
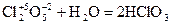 - хлорноватая кислота;
- хлорноватая кислота; 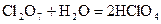 - хлорная кислота.
- хлорная кислота.
Т. е. все оксиды неметаллов обладают кислотным характером и растворимы в воде (исключение SiO2).Пример:  ; n = 1,2,3,4; VA; p - элемент.
; n = 1,2,3,4; VA; p - элемент.
As: 1s22s2p63s2p6d10 4s2p3
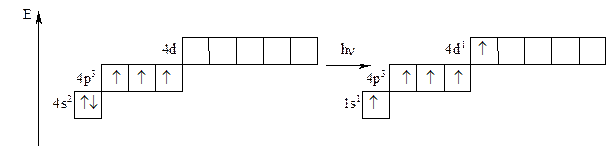 As° As*
As° As*
As-3: 1s22s2p63s2p6d104s2p6;
As° + 3ē → As-3; As-3H3 - арсин.
As° - 3ē → As+3; As+3: 1s22s2p63s2p6d104s2; As2O3 - оксид мышьяка (Ш), амфотерный характер.
As2O3 + H2O = 2HAsO2 - мышьяковистая кислота. Соли мышьяковистой кислоты NaAsO2 - арсениты.
As° - 5ē → As+5; As2O5 - кислотный оксид; As2O5 + H2O = 2HAsO3 - мышьяковая кислота. Соли мышьяковой кислоты, NaAsO3 - арсенаты.
Существуют следующие р - элементы - металлы:
IIIA: Al (амф.), In, Tl (типичные металлы).
IVA: Ge, Sn, Pb (типичные амфотерные элементы), могут проявлять степень окисления +2, +4, могут проявлять отрицательную степень окисления: 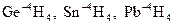 .
.
VA: Sb (амф.).
VIA: Po (амф.).
Рассмотрим соединения олова:
 : 1s22s2p63s2p6d104s2p6d10 5s2p2; n = 1,2,3,4,5; IVA; p - элемент.
: 1s22s2p63s2p6d104s2p6d10 5s2p2; n = 1,2,3,4,5; IVA; p - элемент.
Sn+2: 1s22s2p63s2p6d104s2p6d105s2;
Sn+4: 1s22s2p63s2p6d104s2p6d104s2p6d10.
Оксид олова (II) - SnO – амфотерный
 HCl SnCl2 - хлорид олова
HCl SnCl2 - хлорид олова
 Sn(OH)2
Sn(OH)2
NaOH Na2SnO2 - станнит натрия
Оксид олова (IV) - SnO2 – амфотерный
 HCl SnCl4
HCl SnCl4
 Sn(OH)4
Sn(OH)4
NaOH Na2SnO3 - станнат натрия
H4SnO4; H2SnO3 – оловянная кислота, орто- и мета-форма.
3) d - элементы это элементы, у которых происходит заполнение электронами предвнешнего d подуровня. Они составляют побочные подгруппы. У d - элементов на внешнем уровне 1- 2 электрона (искл. Pd - 0 электронов). Валентными являются электроны внешнего уровня и предвнешнего d - подуровня. Все d - элементы металлы, проявляют только положительную степень окисления. Характер оксидов и гидрооксидов зависит от степени окисления элементов. Низшая положительная степень окисления как правило +2, (искл. - Ag, Au, Cu, степень окисления этих элементов +1), характер оксидов и гидрооксидов - основной. Промежуточная степень окисления равна +3, +4, характер оксидов и гидрооксидов - амфотерный. Высшая положительная степень окисления равна номеру группы (искл. Ag, Au, Cu - степень окисления +3), характер оксидов и гидрооксидов - кислотный.
Рассмотрим пример типичного d - элемента, Mn (марганец).
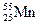 : 1s22s2p63s2p6 d54s2; n = 1,2,3,4; VII B.
: 1s22s2p63s2p6 d54s2; n = 1,2,3,4; VII B.
Mn2+: MnO - основной оксид, Mn(OH)2 – основной гидроксид.
Mn4+: MnO2 – амфотерный оксид, Mn(OH)4 - амфотерный гидрооксид, H2MnO3 - марганцеватистая кислота. Соли марганцеватистой кислоты: Mg2MnO3 - манганиты.
Мn6+; MnO3 - кислотный оксид, H2MnO4 - марганцовистая кислота. Соли марганцовистой кислоты: K2MnO4 - манганаты.
Mn7+; Mn2O7 - кислотный оксид, HMnO4 - марганцевая кислота. Соли марганцевой кислоты: KMnO4 - перманганаты.
4) f - элементы. К ним относятся лантаноиды и актиноиды. В них происходит достраивание предпредвнешнего f- подуровня.
La: - // - // - // - 5d16s2
Ac: - // - // - // - 6d17s2
 : 1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
: 1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
Лантаноиды и актиноиды похожи на типичные d - элементы.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 357; Нарушение авторских прав?; Мы поможем в написании вашей работы!