
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная связь
|
|
|
|
ХИМИЧЕСКАЯ СВЯЗЬ.
Определение. Химической связью называют взаимодействие между атомами, приводящее к образованию молекул или ионов и прочному удерживанию атомов друг около друга.
Химическая связь имеет электронную природу, т. е. осуществляется за счёт взаимодействия валентных электронов. В зависимости от распределения валентных электронов в молекуле, различают следующие виды связей: ионная, ковалентная, донорно-акцепторная, металлическая и др.
Основные положения современной теории ионной связи:
1.) Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
2.) Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s2p6).
Пример: Na + Cl2 = NaCl2
Na: 1s22s2p63s1 Na0 - 1e = Na+ Na+: 1s2 2s2p6
Cl: 1s22s2p63s2p5 Cl0 + 1e = Cl- Cl-: 1s22s2p6 3s2p6
3.) Образовавшиеся разноимённо заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
4.) Ионная связь не направленная.
5.) Не существует 100%-ной ионной связи, т. е. полностью атомы не отдают свои электроны другому атому.
Пример: Fr+0,93F-0,93 - 93%
 FrF Fr+ + F- - при растворении. Ионная связь - частный случай ковалентной связи.
FrF Fr+ + F- - при растворении. Ионная связь - частный случай ковалентной связи.
Ковалентная связь. Основные положения современной теории ковалентной связи.
1.) Ковалентная связь образуется между элементами, сходными по свойствам, т. е. неметаллами.
2.) Каждый элемент предоставляет для образования связей 1 электрон, причём спины электронов должны быть антипараллельными.
3.) Если ковалентная связь образована атомами одного и того же элемента, то эта связь не полярная, т. е. общая электронная пара не смещена ни к одному из атомов. Если же ковалентная связь образована двумя разными атомам, то общая электронная пара смещена к наиболее электроотрицательному атому, это полярная ковалентная связь.
4.) При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в результате, в пространстве между атомами возникает зона повышенной электронной плотности, притягивающая к себе положительно заряженные ядра взаимодействующих атомов, и удерживающая их друг от друга
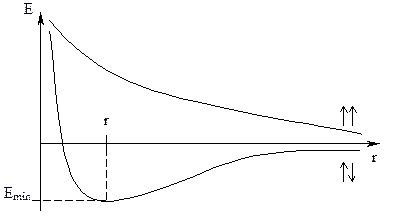
r - расстояние между взаимодействующими векторами.
Для описания ковалентной связи используют 2 метода: метод валентных связей (ВС) и метод молекулярных орбиталей (ММО).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 334; Нарушение авторских прав?; Мы поможем в написании вашей работы!