
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия химии. Объектом изучения в химии являются химические элементы и их соединения
|
|
|
|
Объектом изучения в химии являются химические элементы и их соединения.
Химическим элементом называют вид атомов с одинаковым зарядом ядер. Атом – наименьшая частица элемента, обладающая его химическими свойствами.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов.
Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например He, Ar, H2, O2, S4. Простое вещество является формой существования химического элемента в свободном состоянии. Если молекула вещества состоит из разных атомов, то вещество называют сложным (или химическим соединением), например CO, H2O, H3PO4.
Химические свойства вещества характеризуют его способность участвовать в химических реакциях, т. е. в процессах превращения одних веществ в другие.
Массы атомов, молекул очень малы. Например, массы отдельных атомов составляют 10-24 - 10-22 г. Массы атомов, молекул выражают или в относительных единицах (через массу какого-либо одного определенного вида атома), или в атомных единицах массы (а.е.м.).
1а.е.м.-это 1/12 часть массы атома изотопа углерода 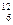 С. 1а.е.м.=1.66053*10-24 г.
С. 1а.е.м.=1.66053*10-24 г.
Значение относительной атомной (Ar) или молекулярной массы (Mr) показывает, во сколько раз масса атома или молекулы больше чем 1/12 часть массы атома изотопа углерода 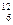 С (углеродная шкала атомных масс). Ar и Мr – безразмерны. Значения Аr приводятся в периодической системе элементов Д.И. Менделеева под символом элемента. Численно Аr и А (а.е.м.) совпадают. Зная относительную атомную массу, легко можно найти и массу атома, выраженную в граммах. Так, масса атома углерода-12 в г равна: 12* 1.66053*10-24= 1.992636*10-23 г. Масса молекулы равна сумме масс атомов, входящих в ее состав.
С (углеродная шкала атомных масс). Ar и Мr – безразмерны. Значения Аr приводятся в периодической системе элементов Д.И. Менделеева под символом элемента. Численно Аr и А (а.е.м.) совпадают. Зная относительную атомную массу, легко можно найти и массу атома, выраженную в граммах. Так, масса атома углерода-12 в г равна: 12* 1.66053*10-24= 1.992636*10-23 г. Масса молекулы равна сумме масс атомов, входящих в ее состав.
Количество вещества (n) – это число структурных единиц (атомов, молекул, ионов, эквивалентов, электронов и т.д.) в системе. Единицей измерения количества вещества является моль. Моль – количество вещества, которое содержит столько определенных структурных единиц, сколько атомов содержится в 12 г изотопа углерода 12С. Число структурных единиц, содержащихся в 1 моле любого вещества в любом агрегатном состоянии, есть постоянная Авогадро: NA=6,02*1023 моль-1.
Молярная масса (М) – это масса 1 моль вещества, равная отношению массы вещества (m) к его количеству (n):
М=m/n.
Основной единицей измерения молярной массы является г/моль (кг/моль). Молярная масса вещества, выраженная в граммах, численно равна относительной молекулярной массе этого вещества.
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равноценна) одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях (ОВР). Эквивалент безразмерен, его состав выражают с помощью знаков и формул так же, как в случае молекул, атомов или ионов.
Для того чтобы определить состав эквивалента вещества и правильно записать его химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента:
А. 2NaOH+H2SO4 =2H2O+Na2SO4.
Краткое ионно-молекулярное уравнение процесса:
2OH- +2H+ =2H2O.
В данной ионообменной реакции участвуют два иона водорода. На один ион водорода приходится:
NaOH+1/2H2SO4=H2O+1/2Na2SO4,
т.е. одному иону водорода соответствует одна молекула NaOH, 1/2 молекулы H2SO4, одна молекула H2O, 1/2 молекулы Na2SO4. Поэтому Э(NaOH)=NaOH; Э(H2SO4)=1/2H2SO4; Э(H2O)=H2O; Э(Na2SO4)=1/2Na2SO4.
Б. Zn+2HCl=ZnCl2+H2
Ионно-электронные уравнения процессов окисления, восстановления:
Zn-2e=Zn2+,
2H++2e=H2.
В данной ОВР участвуют два электрона. На один электрон приходится:
1/2Zn+HCl=1/2ZnCl2+1/2H2,
т.е. одному электрону соответствует 1/2 атома Zn, одна молекула HСl,1/2 молекулы ZnCl2 и 1/2 молекулы Н2. Отсюда Э(Zn)=1/2Zn; Э(HCl)=HCl; Э(ZnCl2)=1/2ZnCl2;Э(H2)=1/2H2.
Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, получило название фактора эквивалентности fэ. Например, в рассматриваемых реакциях fэ(Zn)=1/2, fэ(NaOH)=1.
Для окислительно-восстановительных реакций используют понятие «эквивалентное число» (Z), которое равно числу электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
Моль эквивалента – количество вещества, cодержащего 6,02*1023 эквивалентов. Массу одного моля эквивалента вещества называют молярной массой эквивалента вещества (Мэ), измеряют в г/моль и рассчитывают по формулам:
Мэ=m/nэ; Мэ=fэ*М,
где М – молярная масса вещества, г/моль; νэ – количество эквивалента вещества, моль.
Для расчета молярной массы эквивалента вещества можно использовать следующие формулы:
1. Для простого вещества:
Мэ=МА/В,
где МА – молярная масса атомов данного вещества; В – валентность атома, например, Мэ(Al)=27/3=9 г/моль.
2. Для сложного вещества:
Мэ=М/В*n,
где В – валентность функциональной группы; n – число функциональных групп в формуле молекулы вещества.
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла, для оксидов – оксидообразующий элемент.
Мэ кислоты=Мкислоты/основность кислоты.
Основность кислоты определяется числом протонов, которое отдает молекула кислоты, реагируя с основанием. Например, Мэ(H2SO4)=98/2=49 г/моль.
Мэ основания = Моснования/кислотность основания.
Кислотность основания определяется числом протонов, присоединяемых молекулой основания при взаимодействии его с кислотой. Например, Мэ(NaOH)=40/1=40 г/моль.
Мэ соли=Мсоли/(число атомов металла*валентность металла).
Например, Мэ(Al2(SO4)3)=342/(2*3)=57 г/моль.
Мэ оксида=Моксида/(число атомов оксидообразующего элемента * валентность элемента).
Например, Мэ(Al2O3)=102/(2*3)=17 г/моль.
В общем случае молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
3. Для окислителя, восстановителя:
Мэ=М/Z,
где Z – эквивалентное число.
Как известно, моль любого газа при нормальных условиях (Т=273,15 К, Р=101,325 кПа или 760 мм рт. ст.) занимает объем, равный 22,4 л; этот объем называется молярным объемом Vм. Исходя из этой величины, можно рассчитать объем одного моля эквивалента газа (Vэ, л/моль) при нормальных условиях. Например, для водорода Э(Н2)=1/2Н2, моль эквивалента водорода в два раза меньше его моля молекул и поэтому объем одного моля эквивалента водорода также в два раза меньше его молярного объема: 22,4 л/2=11,2 л. Для кислорода Э(О2)=1/4 О2, отсюда объем одного моля эквивалента кислорода в четыре раза меньше его молярного объема: 22,4 л/4=5,6 л.
В общем случае
Vэ=fэ*Vм.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 313; Нарушение авторских прав?; Мы поможем в написании вашей работы!