
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимические методы. Основы электрохимических методов
|
|
|
|
Основы электрохимических методов. Для проведения электрохимических процессов используют электролизеры. В простейшем виде это два электрода (электронные проводники), погруженные в раствор электролита (ионный проводник), который находится в ванне. Через электроды пропускают обычно постоянный ток. На катоде, т.е. электроде, подсоединенном к отрицательному полюсу источника напряжения, протекают процессы электрохимического восстановления положительно заряженных ионов раствора, т.е. катионов. На инертном аноде, т. е. электроде, подсоединенном к положительному полюсу источника напряжения, протекают процессы электрохимического окисления отрицательно заряженных ионов раствора, т.е. анионов. На растворимом аноде происходит окисление материала анода с переходом его растворимых соединений в раствор. Процессы электрохимического восстановления и окисления количественно описываются известным законом Фарадея.
В зависимости от природы электрохимических процессов, используемых для удаления примесей из сточных вод, различают методы электрохимического окисления и восстановления, электрокоагуляции и флотации, электродиализа.
Электрохимическое окисление и восстановление. Методы электролиза применяют при небольших расходах сточных вод, содержащих повышенные концентрации примесей. Минимальная концентрация солей должна быть не менее 0,5 г/л, чтобы электропроводность сточной воды была достаточной для электролиза. Анодным окислением можно очищать сточные воды от цианидов, аминов, альдегидов, сульфидов, меркаптанов, красителей, нитросоединений, превращая их в СО2, воду, азот, аммиак. Катодным восстановлением можно удалять ионы тяжелых металлов: свинца, ртути, меди, мышьяка, хрома и т. п.
В качестве анодов применяют нерастворимые материалы: графит, магнетит, титан. Катоды: легированная сталь, сплавы железа, свинца, цинка. Для разделения катодного и анодного пространства применяют керамические, полиэтиленовые, стеклянные диафрагмы. Электропроводность раствора увеличивают добавлением 5–10 г/л NaCl. Анодная плотность тока составляет 100–150 А/м2, межэлектродное пространство – 3 см. Эффективность очистки – до 80–100%.
Электрокоагуляция и электрофлотация. В этом методе используют растворимые аноды из железа (стали), алюминия, которые при анодном окислении образуют ионы Fe3+ и Al3+.
Катионы железа и алюминия: а) коагулируют заряженные коллоиды, б) образуют в воде гидроксиды железа или алюминия в виде хлопьев, в) способствуют соосаждению примесей на них. Если напряжение на электролизере достаточно для параллельного разложения воды, то пузырьки газов водорода H2 и кислорода O2, образующиеся при электролизе на катоде и аноде, будут обеспечивать флотацию примесей. Такие электролизеры с растворимыми электродами называют электрокоагуляционно-флотационными.
Электроды в электролизерах располагают в виде набора пластин с расстоянием между ними для стальных электродов 5–10 мм, для алюминиевых – 12–15 мм. Анодная плотность тока 150–250 А/м2 для стальных электродов и 80–120 А/м2 для алюминиевых электродов. Скорость движения воды между электродами от 0,03 до 0,5 м/с. По направлению движения воды и флотирующихся газов электрофлотаторы разделяют на прямо- и противоточные, по располо-жению электродов – на горизонтальные и вертикальные.
Электрокоагуляцию с алюминиевыми анодами применяют для обработки сточных вод, содержащих эмульсии масел, жиров и нефтепродуктов с начальной концентрацией не более 10 г/л. Эффективность очистки от масел 55–70%, от жиров до 92–99%. Стальные электроды используют для электрокоагуляции хроматов, тяжелых металлов, фосфатов, полимеров.
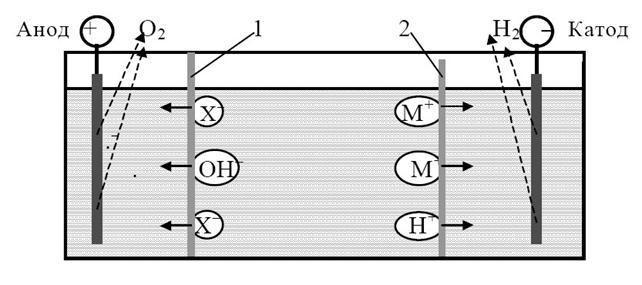
Электродиализ (гр. dialysis – отделение). При электродиализе разделение ионов раствора М+ и Х– происходит под воздействием разности концентраций частиц и разности потенциалов, создаваемой в электродиализаторе по обе стороны мембран. Простейший электродиализатор представляет собой ванну, разделенную на три камеры двумя диафрагмами или мембранами (рис. 23).
|
| Рис. 23. Схема электродиализатора: 1 – анионитовая мембрана; 2 – катионитовая мембрана |
В качестве диафрагм используют инертные пористые природные и синтетические материалы: асбест, стеклоткань, полихлорвиниловую ткань и др. В качестве мембран применяют иониты. От средней камеры анионитовая мембрана 1 отделяет камеру с анодом, а катионитовая 2 – камеру с катодом.
При пропускании через электродиализатор постоянного тока на аноде происходит окисление анионов, обычно ОН–, или выделение кислорода при разложении воды:
2ОН– → О2↑ + 2Н+ + 4е–;
2Н2О → О2↑ + 4Н+ + 4е–.
Образующиеся катионы водорода Н+ не могут переходить через анионитовую мембрану в среднюю камеру. Они увеличивают кислотность в анодной камере. Уменьшение концентрации анионов по сравнению с концентрацией катионов ведет к росту разности потенциала и концентрации анионов между анодной и средней камерой. Это увеличивает скорость перехода анионов Х– из средней камеры в анодную камеру через анионитовую мембрану или диафрагму.
Аналогичное явление, но противоположное по знаку, наблюдается в катодной камере, где происходит катодное восстановление катионов водорода или воды:
2Н+ + 2е– → Н2↑;
2Н2О + 2е– → Н2↑+ 2ОН–.
Раствор в катодной камере обогащается ОН– – ионами, возрастает его рН, дефицит катионов, разность потенциалов. Ускоряется переход катионов М+ из средней камеры в катодную.
Таким образом, при пропускании через электродиализатор постоянного тока анионы Х– из средней камеры переходят в анодную, а катионы М+ – в катодную камеру, практически до полного их удаления. Применение ионитовых мембран позволяет создавать в анодной камере кислую среду, а в катодной – щелочную. Диафрагмы же не мешают переходу Н+– ионов из анодной камеры и ОН– – ионов из катодной камеры в среднюю камеру. В ней они взаимодействуют, образуя воду. Поэтому рН в камерах практически не изменяется.
Аноды и катоды изготавливают из инертных материалов: графита, магнетита, платинированного титана. Число камер в электродиализаторах достигает 100–200. На снижение содержания солей с 250 до 5 мг/л расходуется 7 кВт-ч/м3.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 399; Нарушение авторских прав?; Мы поможем в написании вашей работы!