
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные виды связей
|
|
|
|
Атомы
Представления о химических связях: ковалентные, металлические, ионные связи, связи Ван-дер-Ваальса. Химическая связь в комплексных соединениях
Строение молекул и химическая связь.
Лекция 5
Нет такой избитой темы, которую
нельзя было бы избить еще раз.
Академик А.Л.Бучаченко
- Молекулы – нейтральные частицы с химическими свойствами
- Ионы – заряженные частицы (катионы, анионы);
- Свободные радикалы – частицы со свободной валентностью
·NH2
·CH2
Химическая связь – вид межатомного взаимодействия в молекулах, ионах и кристаллах. Она характеризуется длиной связи, валентным углом и энергией связи.
- Длиной связи называется расстояние между центрами атомов, образующих данную связь (межядерное расстояние)
А В
 ○----------------------○
○----------------------○
межъядерное расстояние

Обычно длина связи составляет ~ 100 пм
Для молекул Н2 – 74, N2 –110, O2 – 121,
H-F–100; H–Cl – 127; H–Br – 141; H-J – 162 пм соответственно.
2. Валентный угол – определяет геометрическое строение молекул
3. Энергия связи – является мерой прочности, это количество энергии, затрачиваемой на ее разрыв.
При разрыве связи энергия затрачивается, т.е. энергия разрыва – всегда положительна; при образовании энергия выделяется, т.е. энергия образования – отрицательна.
 СН4 С + 4Н
СН4 С + 4Н
Энергия разрыва = 1649 кДж/моль
Ес-н = 1649/4 = 412 кДж/моль
Последовательный отрыв атомов водорода от молекулы метана связан с затратой энергии, равной соответственно 427; 368; 519; 335 кДж/моль, но среднее арифметическое значение энергии отрыва совпадает со средней энергией связи:
Е(с-н) = (427 + 368 + 519 + 335)/4 = 412кДж/моль
1. Ионная связь
Структурной единицей являются катионы и анионы.
Связь образуется за счет электростатических сил притяжения между противоположно заряженными ионами (между атомами с резко отличающейся электроотрицательностью).
Электроотрицательность (χ) - способность атома элемента смещать к себе электронную плотность химической связи и равна:
χ = 1\2(I +Е)
I – энергия ионизации;
E – сродство к электрону (с положительным знаком)
Свойства ионной связи: не имеет направленности и ненасыщаема, так как сила притяжения между ионами зависит только от расстояния между ними и не зависит от их взаимной ориентации.
2. Ковалентная связь
Связь образуется за счет электронной пары, принадлежащей обоим связываемым атомам.
Виды ковалентной связи: неполярная и полярная и донорно-акцепторная.
Неполярная ковалентная связь (общие электроны в равной степени принадлежат обоим связываемым атомам) образуется между атомами одного элемента, например, связь в молекулах Н2, Сl2:
Н: Н:Сl:Cl:
Точками обозначены электроны наружного электронного слоя.
Полярная ковалентная связь образуется между атомами элементов с различной электроотрицательностью (сложных веществ). При этом общая электронная пара смещается в сторону более электроотрицательного атома и молекула поляризуется, одна ее часть несет частичный положительный заряд (+δ), другая – отрицательный (-δ).
Например, связь в молекулах LiH и HF:
..
Li:H H:F:
..
+δ -δ +δ -δ
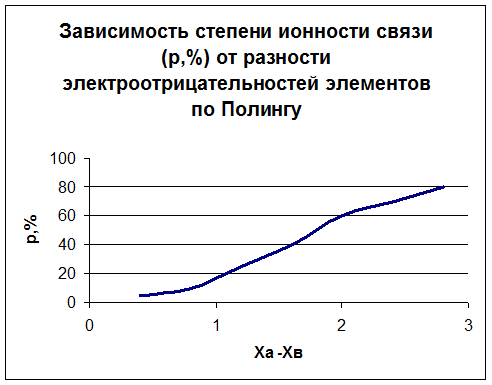
Полярность связи характеризуется дипольным моментом μ = q∙l, где q –абсолютное значение положительного и отрицательного зарядов, l – расстояние между зарядами. Полярность (степень ионности) связи зависит от разности электроотрицательности атомов, составляющих молекулу.
Относительные электроотрицательности элементов (по Полингу)
| H 2,1 | ||||||||||||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | ||||||||||
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,1 | Cl 3,0 | ||||||||||
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 | Co 1,9 | Ni 1,9 | Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | Y 1,2 | Zr 1,4 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru 2,2 | Rh 2,2 | Pd 2,2 | Ag 1,9 | Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,8 | Te 2,1 | I 2,5 |
| Cs 0,7 | Ba 0,9 | La –Lu 1,0 1,2 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,2 | Ir 2,2 | Pt 2,2 | Au 2,4 | Hg 1,9 | Tl 1,8 | Pb 1,9 | Bi 1,9 | Po 2,0 | At 2,2 |
и зависимость степени ионности связи от разности электротрицательности элементов:
 |
Донорно-акцепторная связь образуется при предоставлении донором электронов в общее пользование с акцептором электронной пары, например, связь в ионе аммония, образованном из аммиака (NH3, в котором азот с неподеленной парой электронов является донором) и иона водорода (Н+ - акцептор):
Н
..
Н:N:Н+
..
Н
Свойства ковалентной связи: направленность и насыщаемость.
Связь направленная, так как она образуется по направлениям, которые имеют орбитали валентных электронов, между направлениями связи – валентные углы.
Связь насыщаема, так как образуется одной парой электронов.
3. Водородная связь
Связь частично электростатического, частично ковалентного характера, осуществляемая атомом водорода, соединенным в молекулу с атомом сильно электроотрицательного элемента (фтор, кислород, азот), с другими электроотрицательными атомами, например, между атомами водорода и кислорода в воде.
Н+δ Н+δ
 -δО ……………...+δН -δО
-δО ……………...+δН -δО


 Н+δ
Н+δ
4. Металлическая связь
Для металлов характерен особый тип связи: валентные электроны всех атомов объединяются в так называемый электронный газ и свободно двигаются в кристаллической решетке, образованной ионами. Каждый электрон принадлежит всем атомам одновременно, и кристалл металла можно рассматривать как одну гигантскую молекулу.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 774; Нарушение авторских прав?; Мы поможем в написании вашей работы!