
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпийный и энтропийный факторы процесса. Энергия Гиббса
|
|
|
|
Чтобы система была устойчивей, ее надо трясти.
Академик В.Н.Челомей
Процессы, протекающие в любой термодинамической системе характеризуются двумя противоположными тенденциями:
- стремление к минимальной внутренней энергии;
- направленность к наиболее вероятностному состоянию, т.е. к состоянию, которому соответствует максимальная беспорядочность распределения частиц.
Эти тенденции количественно выражаются через ΔН и ΔS.
Энтальпия Энтропия
Н=U +PV S =klnW
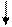
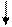

 ΔН → 0 ΔS→ ∞
ΔН → 0 ΔS→ ∞
Термодинамическая характеристика Термодинамическая
характеристика

 состояния системы состояния системы
состояния системы состояния системы
Взаимодействие атомов в молекуле, Мера неупорядоченности,
укрупнение, объединение частиц дезагрегация системы,

 стремление к минимуму разброс частиц
стремление к минимуму разброс частиц
ΔН → min, когда ΔS =0
кДж\моль (Ккал\моль) кДж\(моль∙К)
 |
В состоянии равновесия обе тенденции проявляются в равной мере:


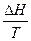 ΔS
ΔS
энтальпийный фактор энтропийный фактор
 процесса процесса
процесса процесса


|
Примеры равновесных систем:
- кипящая жидкость – пар;
- плавящийся кристалл – отвердевающая жидкость;
- насыщенный раствор – кристаллы растворенного вещества.
Для химической реакции - это равновесие между исходными веществами и продуктами взаимодействия.

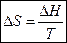 расчет изменения энтропии в равновесном процессе
расчет изменения энтропии в равновесном процессе
ΔН можно определить экспериментально с помощью калориметрии.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1198; Нарушение авторских прав?; Мы поможем в написании вашей работы!