
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика химических реакций
|
|
|
|
Лекция 8
Задачи
III закон термодинамики
Для расчета равновесных состояний систем используются измерения термических величин (теплоемкость, тепловой эффект), что позволяет избежать многочисленных исследований состояния равновесия, расчеты равновесия основаны на 3-ем законе термодинамики, который формулируется как 2 утверждения:
1) при приближении температуры к абсолютному нулю величины теплоемкости (СР, СV) всех тел становятся равными нулю;
2) энтропия простых кристаллических тел стремится к нулю при приближении температуры к абсолютному нулю.
- Рассчитайте стандартную энтропию оксида железа(III), если известна энтропия реакции:
2FeO(к) + О2(г) = 2 Fe2O3(к); ∆Sх.р. = -259 Дж\К
S(FeO(к))= 58,79 Дж\ моль∙К; S(О2(г)) = 205,04 Дж\моль∙К
- Рассчитайте стандартные энтропии следующих химических реакций:
Al2(SO4)3(к) = Al2O3(к) + 3SO3(г)
2Н2О2(ж) = 2Н2О(ж) + О2(г)
2Al2O3(к) + 6SO2(г) + 3О2(г) = 2Al2(SO4)3(к)
S(Al2(SO4)3(к))= 254,3 Дж\ моль∙К; S(Al2O3(к)) = 50,9 Дж\моль∙К;
S(SO3(г))= 256,23 Дж\ моль∙К;
S(Н2О2(ж))= 109,6 Дж\ моль∙К; S(Н2О(ж)) = 70,08 Дж\моль∙К;
S(О2(г))= 205,04 Дж\ моль∙К;
S(SO2(г))= 248,1 Дж\ моль∙К.
3. Не производя вычислений, укажите для каких из перечисленных реакций изменение энтропии способствует самопроизвольному протеканию реакций:
MgO(к) + H2(г) = Mg(к) + H2O(ж)
FeO(к) + C(графит) = Fe(к) +CО(г)
2ZnS(к) + 3O2(г) = 2ZnO(т) + 2SO2(г)
Al2(SO4)3(к) = Al2O3(к) + 3SO3(г)
4. Определите область температуры, в которой возможен самопроизвольный процесс при стандартном состоянии всех веществ
H2S + Cl2 = 2HCl +S(к)
ΔG0298 (H2S) = -33,01кДж\моль; ΔG0298 (HCl) = -95,27кДж\моль;
5. Определите возможность самопроизвольного протекания реакции при стандартных состояниях всех веществ и 298 К
CaSO4(к) + CO2(г) = CaCО3(к) + SO3(г)
ΔG0298 (CaSO4(к)) = -1318,3кДж\моль; ΔG0298 (CO2(г)) = -394,38кДж\моль;
ΔG0298 (CaCО3(к)) = -1128,76кДж\моль; ΔG0298 (SO3(г)) = -370,4кДж\моль;
6. Исходя из реакции
SiO2(к) + 2NaОН(р-р) = Na2SiO3(к) + H2O(ж)
ответьте, можно ли выпаривать щелочь в стеклянном сосуде, если
ΔG0 NaОН = -419,5 кДж ΔG0 Na2SiO3(к) = -1427,8 кДж
ΔG0 Н2О= -237,2 кДж ΔG0 SiO2(к) = -805,2 кДж
Случайные открытия делают только подготовленные умы.
Б.Паскаль
Значение энергии Гиббса позволяет судить о принципиальной возможности протекания процесса, но не определяет его скорость.
Изучением исследования течения реакции во времени занимается химическая кинетика.
 |
Элементарные (одностадийные)
 в системе протекает только один процесс,
в системе протекает только один процесс,
- Химические уравнение реакции отражает ее механизм
 реакции
реакции
Сложные (суммарный результат нескольких
элементарных процессов)
уравнение реакции не отражает их реальный
механизм
 Гомогенные (в объеме фазы)
Гомогенные (в объеме фазы)
- Химические
 реакции
реакции
Гетерогенные (на границе раздела фаз)
Число актов взаимодействия, происходящих в единицу времени (для гомогенных реакций – в единице объема, для гетерогенных - на единице раздела фаз), определяет скорость реакции.
Мгновенная скорость ν в данный момент времени τ выражает изменение количества n реагирующих веществ в единице V реакционного пространства:
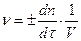
Для гомогенных реакций скорость можно выразить как изменение во времени концентрации:
 , где с=n\V – концентрация любого реагента
, где с=n\V – концентрация любого реагента
На скорость реакции влияют:
- природа и концентрация растворов;
- давление;
- температура;
- катализаторы;
- примеси;
- степень измельчения;
- среда.
Наиболее важны:
- концентрация;
- температура;
- действие катализаторов;
- давление (для газовых реакций)
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1023; Нарушение авторских прав?; Мы поможем в написании вашей работы!