
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бор и его соединения
|
|
|
|
В природе бор встречается в виде борной кислоты, которая содержится в воде горячих источников. Соединения бора содержатся также в нефтяных буровых водах. В природе распространена соль борной кислоты - бура Na2B4O7 10 H2O.
В большинстве соединений бор трехвалентен, в соединениях же с водородом он может проявлять иную валентность. Из кислородных соединений бора наиболее распространен борный ангидрид В2О3, который очень гигроскопичен. В свободном виде известны две разновидности борной кислоты: метаборная кислота – НВО2 и ортоборная кислота – Н3ВО3.
| Н3ВO3 | Кислота борная Acidum boricum |
Описание. Растворимость. Блестящие, жирные на ощупь, бесцветные, прозрачные чешуйчатые кристаллы или мелкий белый кристаллический порошок, без запаха. Плохо растворим в холодной воде, хорошо растворим в горячей воде, растворяется в спирте 1:25 и медленно в глицерине 1:7. Борная кислота возгоняется с парами воды и спирта.
При нагревании кристаллов борной кислоты постепенно теряется вода. При 100° С образуется метаборная кислота, затем - тетраборная кислота, а затем - остаток оксида бора (III). При реагировании с водой все эти соединения снова образуют борную кислоту.
1000 С 1800 С
Н3ВО3 ® НВО2 ® H2B4O7 ® 2 В2О3
борная - H2O метаборная - H2O тетраборная - H2O оксид бора
кислота кислота кислота
Водные растворы борной кислоты имеют слабокислую реакцию. При добавлении щелочи образуются соли тетраборной кислоты - тетрабораты или реже метаборной кислоты - метабораты. Соли ортоборной кислоты неизвестны.
Глицериновые растворы борной кислоты имеют более выраженную кислую реакцию в результате образования одноосновной комплексной кислоты:




 _
_
СН2ОН СН2ОН НОН2С
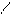
 Н3ВО3 + 2 СНОН ® СН – О – В – О – НС Н + + 3 H2O
Н3ВО3 + 2 СНОН ® СН – О – В – О – НС Н + + 3 H2O
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!