
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константы скоростей реакции образования алкильного радикала
|
|
|
|
| №п/п | Наименование углеводорода | Константа скорости, см3/(молекула∙с) |
| Метан | 8,1∙10-15 | |
| Этан | 3,0∙10-13 | |
| Пропан | 1,9∙10-12 | |
| Бутан | 2,4∙10-12 | |
| Пентан | 5,0∙10-12 |
Из данных этой таблицы видно, что при переходе от метана к этану и пропану скорость резко увеличивается, но затем её изменения становятся относительно небольшими.
Наличие углерод - углеродных связей в молекулах алканов приводит к появлению новых направлений в реакциях фотоокисления. Происходит расщепление и изомеризация промежуточно образующихся радикалов.
Рассмотрим процесс окисления на примере н-бутана так как он позволяет показать все стадии характерные для более высоких гомологов, и в то же время достаточно прост. Поэтому он часто используется для численного моделирования процессов смогообразования.
Атака гидроксила может происходить по метильной или метиленовой группе и приводить к образованию первичного или вторичного радикала:
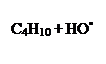

 СН3СН2СН2СН2• + Н2О (6.1)
СН3СН2СН2СН2• + Н2О (6.1)
 СН3СН2СН2•СН3 + Н2О (6.2)
СН3СН2СН2•СН3 + Н2О (6.2)

Отщепление вторичного атома идет с большей скоростью, поэтому эта реакция на 85 % протекает по уравнению 6.2.
Бутильные радикалы при столкновении с молекулами кислорода дают соответствующие алкилпероксидные радикалы:
С4Н9• + О2 => С4Н9ОО• (6.3)
Последние, подобно метилпероксидному радикалу вступают во взаимодействие с оксидом азота, образуя бутоксильные радикалы и бутилнитраты.

 + NO С4Н9О• + NO2 (6.4)
+ NO С4Н9О• + NO2 (6.4)
 С4Н9ОО•
С4Н9ОО•
 С4Н9ООNO
С4Н9ООNO
I. Бутоксильные радикалы подвергаются превращениям. Взаимодействуют с молекулами кислорода с образованием карбонильного соединения.
С2Н5—СНСН3 + О2 => С2Н5—С—СН3 + НОО• (6.5)
│ ║
О• О
изобутоксильный радикал кетон
II. Расщепление С-С связи, которое протекает наиболее быстро в случае вторичных и третичных радикалов.

 С2Н5• + СН3СН=O (уксусный альдегид) (6.6)
С2Н5• + СН3СН=O (уксусный альдегид) (6.6)
С2Н5—СНСН3
 │ СН3• + С2Н5СН=O (пропионовый альдегид)
│ СН3• + С2Н5СН=O (пропионовый альдегид)
 О•
О•
III. Радикалы подвергаются внутримолекулярной перегруппировке с перемещением радикального центра с О на С.
С2Н5• + О2 → С2Н5О• (этилперокс радикал) (6.7)
С2Н5О2• + NО → С2Н5О• + NО2 (6.8)
С2Н5О2• + О2 → СН3СН=О + НО2• (6.9)
кетон
Алкены - реакции с О 3
Алкены, содержащие в составе молекулы двойную углерод-углеродную связь обладают высокой реакционной способностью. Наибольшее значечие имеют реакции взаимодействия с атомарным кислородом, гидроксильным радикалом и озоном.
Таблица 6.3
Константы скорости взаимодействия (см3/(молекула∙с)) с алкенами
| Углеводород | НО• | О(3Р) | О3 |
| Этилен | 1,77 ∙ 10-12 | 8,3 ∙ 10-13 | 1,1 ∙ 10-18 |
| Пропилен | 2,4 ∙ 10-11 | 2,3 ∙ 10-12 | 5,5 ∙ 10-18 |
| транс -2-Бутен | 7,1 ∙ 10-11 | 1,8 ∙ 10-11 | 2,6 ∙ 10-16 |
Наиболее детально исследованы механизмы фотохимического окисления этилена и пропилена.
Реакции пропилена с О(3Р)
Атомарный кислород активно взаимодействует с пропиленом, присоединяясь к двойной связи. Предполагается, что на первой стадии происходит образование мостиковой структуры, стабилизация которой приводит к пропиленоксиду или пропионовому альдегиду, а взаимодействие с молекулярным кислородом - к разрыву углерод-углеродной связи.
О О
/ \ / \
СН3СН=СН2 + О(3Р) → СН3СН=СН2 → СН3СН-СН2 + С2Н5СН=О
↓2О2
СН3О2• + СН3С(О)О2•


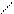 О О
О О
 СН3—С + NO2 → СН3С
СН3—С + NO2 → СН3С

 ОО• ООNO2
ОО• ООNO2
В результате дальнейших превращений образовавшихся радикалов и их взаимодействия с оксидами азота и гидропероксидными радикалами образуются пропиленоксид, пропионовый альдегид, надуксусная кислота, пероксиацетилнитрат, формальдегид, метанол, диметиловый эфир и метилнитрат.
Хотя реакция пропилена с атомарным кислородом протекают с большой скоростью, роль её ограничена из-за малой концентрации атомарного кислорода в приземных слоях воздуха.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 381; Нарушение авторских прав?; Мы поможем в написании вашей работы!