
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические уравнения и реакции
|
|
|
|
Закон сохранения массы
Стехиометрия и закон эквивалентов
Моль и его значение в химии
Химические уравнения реакции
Закон сохранения массы
Введение
Закон сохранения массы и стехиометрия
Тема 2
Контрольные вопросы
Введение
В предыдущей теме мы отметили, что М.В. Ломоносов и А.Л. Лавуазье были одними из первых, которые изучили химические процессы, соблюдая тщательные количественные измерения и наблюдения. Их исследования и легли в основу закона сохранения массы- одного из важнейших законов химии, направленных на решение практических задач. Эти задачи включают определение количественных соотношений между веществами, подвергающимися химическим превращениям. Изучением подобных количественных соотношений занимается стехиометрия, основным и законами которой считается законы эквивалентов и сохранения массы.
Изучение суммарной массе исходных реагентов. Это наблюдение обобщено в законе сохранения массы. Однако, соотношение между массой и энергией, которое выражается уравнением E = Δmс2 (Е-энергия, Δm -изменение массы, с-скорость света), вносит незнчительную поправку к этому закону. Так, если реакция протекает с выделением тепла (энергии), то масса продуктов такой реакции будет уменьшатся на величину Δm, а при поглощении энергии из окружающей среды- увеличивается на Δm. Для практики эти отклонения не имеют существенного значения, так как изменения массы Δm реакции составляют примерно 10-8 -10-9 г, что не учитывается.
Химические вещества записываются с помощью символов и формул. Формулы же используются для записи химических уравнений, которые описывают химические реакции. В качественном отношении химические уравнения указывают какие реагенты и продукты участвуют при протекании процесса. В количественном же отношении химические уравнения соответствуют закону сохранения массы, то есть, в его левой и правой частях должно содержаться одинаковое количество атомов каждого сорта. Например, при горении пропана неполное уравнение реакции записывается в виде:
|
|
|
C3H8+О2=СО2+Н2О (2.1)
В нем реагенты указаны в левой части уравнения, а продукты в правой.
химических реакций показало, что суммарная масса продуктов реакции равна
Основанием для подстановки стехиометрических коэффициентов в этой реакции служат количество атомов С, Н и О, которые определяются индексами в формулах (справа внизу). Следовательно, в левой части уравнения имеется 3 атома С, 8 атомов Н и 2 атома кислорода; Это же количество атомов должно быть и в продуктах реакции. Для уравнивания количества этих атомов слева и справа уравнения нужно коэффициенты у водорода и углерода проставить таким образам, чтобы количество их атомов в реагентах и продуктах было одинаковым. Следовательно, около молекулы СО2 нужно поставить коэффициент 3, а у Н2О коэффициент 4:
С3Н8+О2=3СО2+4Н20
Осталось в этом уравнении сбалансировать количество атомов кислорода. Как видно из правой части уравнения, число атомов кислорода равно 10, тогда в реагентах перед кислородом необходимо поставить цифру 5. Окончательно уравнение (2.1) принимает вид:
С3Н8+5О2=3СО2+4Н2О
3*С,10*О,8*Н 3*С, 10*О, 8*Н (БАЛАНС ПО ЭЛЕМЕНТАМ) (2.2)
РЕАГЕНТЫ ПРОДУКТЫ
Баланс атомов в уравнениях соблюдается (по количеству каждого сорта атомов), чего нельзя сказать о молекулах, так как в уравнении (2.2) реагенты содержат 6 молекул, а продукты 7.
В химических реакциях часто указывают агрегатное состояние участников реакции, помещая за формулами в скобках символы (г.), (ж.), (т.), (водн.), что соответствует газообразному. Жидкому, твердому и растворенному в воде состоянию веществ. Иногда. При выделении газообразного продукта, за его формулой помещают вертикальную стрелку остреём вверх (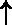 ), а стрелка вниз (
), а стрелка вниз ( ) указывает на твердое вещество, выпадающая в осадок. Например:
) указывает на твердое вещество, выпадающая в осадок. Например:
|
|
|
2Na(т) +2H2O (ж) =2NaOH (вон.) +H2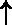 (2.3)
(2.3)
Вместо знака равенства(=) в уравнениях можно ставить стрелку( прямая реакция,
прямая реакция,  обратная реакция). Над стрелкой можно записывать условия реакции (температуры, давления, присутствие катализатора и др.). Две противоположно направленные стрелки указывают на установившиеся химическое равновесие(
обратная реакция). Над стрелкой можно записывать условия реакции (температуры, давления, присутствие катализатора и др.). Две противоположно направленные стрелки указывают на установившиеся химическое равновесие( ), когда скорость прямой (
), когда скорость прямой ( ) реакции равна скорости обратной (
) реакции равна скорости обратной ( ) реакции.
) реакции.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 367; Нарушение авторских прав?; Мы поможем в написании вашей работы!