
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика МО
|
|
|
|
Основные положения метода МО ЛКАО
Недостатки метода ВС
1. Не мог описать парамагнитных свойств отдельных молекул. Например, при температуре – 220 0 С кислород меняет свое агрегатное состояние и переходит в жидкость, которая притягивается магнитом. Атомы проявляют парамагнитные свойства только тогда, когда имеют один или несколько неспаренных электронов. По методу ВС молекула кислорода не имеет неспаренных электронов и не может проявлять пармагнитных свойств. Что опровергается практикой.
2. Не мог описать существование ионных молекул. В конце XIX века доказано существование прочного молекулярного иона Не2+, описать образование которого нельзя с помощью метода ВС.
Для ликвидации этих недоработок был разработан метод молекулярных орбиталей.
Метод молекулярных орбиталей как линейная комбинация атомных орбиталей МО ЛКАО
1. Образование химической связи является переход электронов с атомных орбиталей (АО) на новые энергетические уровни молекулярные орбитали (МО), обладающие энергией, определяемой всеми атомами молекулы;
2. После образования МО АО теряют свою индивидуальность;
3. Каждой МО соответствует определенная энергия;
4. Электроны в молекуле не локализованы в межъядерных пространствах, они могут в ряде случаев перемещаться в электрическом поле нескольких ядер
5. Распределение электронов по новым энергетическим уровням производится в соответствии с принципом Паули и правилом Гунда
6. Если переход электронов на новые энергетические уровни приводит к понижению полной потенциальной энергии системы то химическая связь образуется, если переход электронов связан с затратой энергии то не образуется.
Плотность вероятности нахождения электрона в пределах энергетического уровня определяется волновой функцией (ψ). В многоэлектронных атомах в пределах одной атомной орбитали знак волновой функции может быть различен (+ или -). Знак + свидетельствует о 95% вероятности нахождения электрона в данной области. При образовании химической связи возможны следующие перекрывания атомных орбиталей: положительное, когда максимум электронной плотности находится в межъядерном пространстве; отрицательное – электронная плотность находится за ядрами и нулевое. При положительном перекрывании образуется связующая молекулярная орбиталь, при отрицательном- разрыхляющая, при нулевом – молекулярная орбиталь не образуется.

 Энергетически выгодна связующая МО. Но, опираясь на принцип неопределенности Гейзенберга, нельзя с максимальной долей вероятности предполагать только положительное перекрывание. Следовательно с такой же долей вероятности возможно существование и разрыхляющей орбитали. Соответственно при перекрывании двух АО образуются две МО, одна из которых связующая, вторая разрыхляющая. Образование молекулярных орбиталей из атомных обычно изображают в виде энергетических диаграмм, где по вертикали откладывается значение энергии, слева и справа – энергетические уровни атомных орбиталей, в середине энергетические уровни молекулярных орбиталей.
Энергетически выгодна связующая МО. Но, опираясь на принцип неопределенности Гейзенберга, нельзя с максимальной долей вероятности предполагать только положительное перекрывание. Следовательно с такой же долей вероятности возможно существование и разрыхляющей орбитали. Соответственно при перекрывании двух АО образуются две МО, одна из которых связующая, вторая разрыхляющая. Образование молекулярных орбиталей из атомных обычно изображают в виде энергетических диаграмм, где по вертикали откладывается значение энергии, слева и справа – энергетические уровни атомных орбиталей, в середине энергетические уровни молекулярных орбиталей.
Примеры энергетических диаграмм
На рисунке изображена энергетическая диаграмма молекулы водорода. Все электроны, находящиеся на атомных орбиталях занимают σ – связующую молекулярную орбиталь. Разрыхляющая σ-орбиталь остается незаполненной. Характер распределения электронов по МО орбиталям позволяет оценить кратность связи, которая рассчитывается по формуле:

 Чем больше кратность связи, тем прочнее молекула. Для молекулы водорода кратность связи равна
Чем больше кратность связи, тем прочнее молекула. Для молекулы водорода кратность связи равна 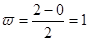 . Если кратность связи больше 0, то принято считать, что она существует. Если меньше 0, то ее существование невозможно.
. Если кратность связи больше 0, то принято считать, что она существует. Если меньше 0, то ее существование невозможно.
В многоэлектронных атомах элементов 2-го периода в образовании МО кроме s –орбиталей принимают участие и р-орбитали. Согласно спектроскопическим данным молекулярные орбитали двухатомных молекул элементов находящихся в конце периода заполняются следующим образом:
σсв2s< σраз2s< σсв2pz<πсв 2py = πсв 2pх< πраз 2py = πраз 2pх < σраз2pz
По этому принципу заполняются молекулярные орбитали в молекуле кислорода.
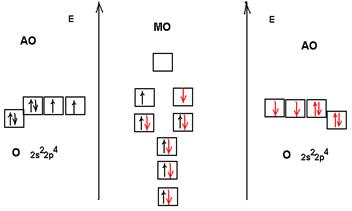 Два неспаренных электрона находятся на разрыхляющих πраз 2py и πраз 2pх орбиталях, тем самым обеспечивая парамагнитные свойства.
Два неспаренных электрона находятся на разрыхляющих πраз 2py и πраз 2pх орбиталях, тем самым обеспечивая парамагнитные свойства.
Кратность связи в молекуле кислорода равна

Если πраз 2py и πраз 2pх орбитали не заполняются, то наблюдается взаимное отталкивание σраз2s и σсв2pz орбиталей. В этом случае энергетически предпочтительнее заполнение πсв 2py и πсв 2pх орбиталей. Такое явление наблюдается в молекулах, образованных атомами стоящими в начале периодов, например у азота.

Кратность связи в молекуле азота будет равна:

|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1348; Нарушение авторских прав?; Мы поможем в написании вашей работы!