
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Любая система стремится к уменьшению свободной энергии и устойчивому состоянию, которому соответствует состояние с наименьшим значением свободной энергии
|
|
|
|
Любая система стремится перейти в состояние равновесия, которое является наиболее устойчивым состоянием системы.
Формулировка 2-го закона термодинамики.
Изобарно – изотермический потенциал химической реакции зависит не только от абсолютного количества вещества, но и от концентрации веществ, участвующих в реакции. Эта зависимость выражается в уравнении изотермы Вант – Гоффа.
аА + bВ = сС + dD
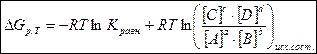 ,
, 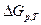 - изменение свободной энергии Гиббса при постоянном давлении и температуре.
- изменение свободной энергии Гиббса при постоянном давлении и температуре.
[C], [D], [А], [В] – концентрации веществ, участвующих в реакции.
R – универсальная газовая постоянная.
Т – абсолютная температура.
Кравн. – константа равновесия.
Изменяя концентрации веществ в исходном состоянии, можно изменить и DG реакции, т. е. добиться таким путём желаемого направления и глубины процесса.
Стандартное состояние: [C] = [D] = [А] = [В] =  , температура = 298°К, давление = 101,325кПа.
, температура = 298°К, давление = 101,325кПа.
Стандартная изотерма Вант – Гоффа.
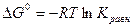
Пример термодинамического расчёта химической реакции:

Возможно ли при стандартных условиях самопроизвольное протекание процесса?
DG° = DH° - TDS°
| Вещества | 
| 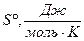
|
| CaCO3(к) | -1207 | 88,7 |
| CaO(к) | -635 | 39,7 |
| СО2(г) | -393,5 | 213,7 |
По 2-ому следствию закона Гесса:
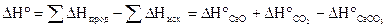 = + 178,5 (кДж).
= + 178,5 (кДж).
DH > 0.
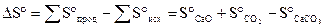 = 164,7
= 164,7 .
.
DS > 0.
DG° = DH° - TDS° = 178,5 – 298×164,7×10-3 = 129,6 (кДж).
DG > 0.
Выводы:
1. DH>0, процесс эндотермический, энтальпийный фактор против самопроизвольности процесса.
2. DS>0, система стремится к беспорядку, энтропийный фактор за самопроизвольность процесса.
3. DG>0, при стандартных условиях невозможно самопроизвольное протекание процесса.
Вопрос: при каких условиях возможно протекание процесса?
Вычислим температуру равновесного состояния:
DG = 0 Þ DН - TравнDS = 0 Þ DН = ТравнDS,
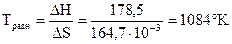 , при Т > 10840K, DG<0, следовательно, данный процесс может протекать при температурах выше 10840К
, при Т > 10840K, DG<0, следовательно, данный процесс может протекать при температурах выше 10840К
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 598; Нарушение авторских прав?; Мы поможем в написании вашей работы!