
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия. Молекулярная физика и термодинамика
|
|
|
|
Молекулярная физика
Лекция № 6
Молекулярная физика и термодинамика
Атомы. Температура. Тепловое равновесие. Тепловое расширение. Идеальный газ. Законы идеального газа. Число Авогадро. Реальные газы. Уравнение Ван-дер-Ваальса. Основное уравнение молекулярно-кинетической теории. Распределение молекул по скоростям. Фазовые переходы. Критическая температура. Тройная точка. Сублимация. Испарение. Конденсация. Кипение. Влажность. Точка росы. Диффузия.
Открытия в области физики молекул и газов позволили ученым убедить экспериментально в то, что все вещества, в том числе и живые организмы, состоят из мелких и неделимых частиц – атомов. Человек осознал и научился использовать такие понятия как масса, объем, давление и температура. Были созданы устройства, позволяющие их измерять. Между ними были установлены закономерные связи, открыты законы газов.
Исследования в области физики молекул позволили сделать важный шаг к развитию химии и биохимии. Эти исследования стали толчком в развитии еще одного направления в науке – статистической физики.
Описание условия существования различных веществ, например газа, или их состояния можно осуществлять с помощью различных теоретических подходов. К таким описаниям системы относятся микроскопическое и макроскопическое. Микроскопическое описание – рассматривает детали движения и взаимодействия молекул в рамках кинетической теории и статистической механики[1]. Пример микроскопического описания – это использование законов механики для описания движения и столкновения между собой молекул или атомов. Составленные, таким образом системы уравнений позволяют объяснить, например, давление или получить уравнение газового состояние с точки зрения микроскопического описания. Макроскопическое описание осуществляется через физические величины, измеряемые нашими органами чувств: массу, объем, давление, температуру. Например, состояние газа в сосуде описывается тремя переменными: V (объем), P (давление), T (температура).
Такие величины называют параметрами состояния. Изучением процессов с помощью макроскопических величин занимается термодинамика.
Кинетической называют теорию, согласно которой вещество состоит из атомов, совершающих непрерывное хаотическое движение.
Атомы. Идея о существовании мельчайших неделимых частиц принадлежит древнегреческому философу Демокриту[2] (рис.6.1). Эти частицы он назвал атомами (от древнегреческого слова «атомос» - «неделимый»).

Рис.6.1. Древнегреческий философ Демокрит.
Экспериментальные подтверждения справедливости атомной теории были получены лишь в восемнадцатом веке. Вполне естественным является объяснение таких характеристик веществ как проницаемость, сжимаемость, растворимость тем, что вещество не является сплошным, состоит из отдельных частиц, между которыми есть промежутки. Притяжение молекул и атомов является причиной существования твердых и жидких тел. Однако при приближении атомов друг к другу между ними возникают силы отталкивания. Таким образом, средние расстояния между атомами остаются примерно одинаковыми. Видно, что сжать воду или какое-либо твердое тело практически невозможно.
Элементом доказательства справедливости атомного строения вещества был закон постоянства состава веществ [3] (рис.6.2), который утверждает, что вещества не могут смешиваться, как попало, а всегда соединяются в одних и тех же пропорциях. Это указывало на то, что вещества состоят из крупинок, которые могут соединять определенными способами. Следующий шаг был сделан Джоном Дальтоном[4] (рис.6.3), который открыл закон кратных отношений.


Рис.6.2. Ж.Пруст. Рис.6.3. Д.Дальтон.
Согласно этому закону два вещества, соединяясь друг с другом, могут образовывать несколько различных соединений. Однако количества одного вещества в разных соединениях относятся друг к другу как целые числа. Этот факт, как он отмечал, сравнивая свои выводы с законом Пруста, можно объяснить, лишь применяя теорию атомного строения вещества.
Еще одним подтверждением этого вывода оказалась диффузия – явление самопроизвольного взаимного проникновения веществ (рис.6.4). Это, например, запахи при диффузии в газах, самопроизвольное смешивание различных слоев жидкостей. Пример диффузии в твердых телах – взаимопроникновение частиц из двух отполированных пластинок меди и свинца, если их прижать друг к другу на длительное время. Если бы вещество было сплошным, это явление не происходило бы.
Ярким экспериментальным доказательством атомного строения вещества явились опыты английского ботаника Броуна в 1827 году (рис.6.5).
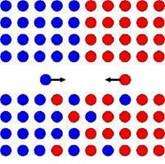
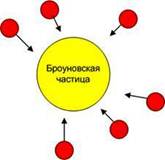
Рис.6.4. Диффузия. Рис.6.5. Броуновское движение.
Он обнаружил в микроскоп, что крупинки цветочной пыльцы непрерывно хаотически движутся. Их беспорядочное движение объяснялось столкновениями с молекулами воды. Интенсивность такого движения обусловлена соотношением массы частиц и молекул воды. Массивные частицы не испытывали хаотического движения. Мелкие – при столкновениях с молекулами воды сильно изменяют направление своего движения. Количественная теория броуновского движения была разработана Эйнштейном в 1905 году. Он на основе экспериментальных данных оценил размер и массу атомов и молекул, которые составили приблизительно 10-10м и 10-27кг.
Самому легкому атому был приписан атомный вес, равный единице. В этом случае атомный вес углерода равен примерно 12, кислорода – примерно 16 и т.д.
В настоящее время применяется углеродная нормировка веса атомов. В этом случае вес атома углерода принимается за 12. Атомные веса других атомов и молекул нормируются на атомный вес углерода (являются относительными атомными массами). Относительные массы атомов и молекул называют атомной или молекулярной массой. Атомная масса водорода в углеродных единицах составляет  .
.
Температура. Представление о горячем и холодном мы связываем с понятием температуры. Температура влияет на многие свойства веществ: плотность, объем, давление, электрическое сопротивление, вязкость, цвет и т.д. Уже в древние времена ученые пытались и не безуспешно теплом лечить различные недуги.
Измерение температуры осуществляется прибором – термометром. Первый такой прибор был изобретен в семнадцатом веке Галилеем, в нем ученый использовал расширение газа. Газовый термометр приведен на рис. 6.6. Термометр работает при постоянном объеме для разных типов газов.
Физический принцип действия такого прибора построен на основе закона Шарля, описанного ниже формулой (6.4.2). При постоянном объеме (V=const) давление в манометре пропорционально температуре P ~ T. По разнице уровней в проградуированных трубках манометра, определяется температура окружающего термометр воздуха. Однако точность такого прибора была не высока, поскольку плотность газа и его объем сильно зависели от температуры.
Современные термометры, широко используемые в повседневной жизни, действуют чаще всего на основе закона линейного и объемного расширения жидкостей (ртути, подкрашенного спирта и др.). Эти законы описаны в разделе 6.3. Принцип действия термометров заключается в том, что жидкость заполняет объем небольшого резервуара, соединенного с тонким капилляром. При нагревании резервуара ртуть или подкрашенный спирт, плотность которых при изменении температуры, практически не изменяется, заполняют капилляр. Высота столбика жидкости в капилляре пропорциональна температуре. В более точных термометрах учитывается и расширение стеклянной трубки, в которую заливают жидкость. С ростом температуры наполняющие его жидкости ртуть или спирт расширяются быстрее, чем стекло. В термометрах при более высоких температурах используются также металлические стержни, биметаллические пластинки.

Рис. 6.6. Устройство газового термометра.
1-заполненный газом объем; 2-капилляр; 3-манометр.
Для измерения температуры используется стоградусная шкала Цельсия, в которой деление на сто единиц происходит между точками кипения (100ºС) и замерзания воды (0ºС) (рис.6.7а). Основной шкалой температур, применяемой в физике, является абсолютная шкала температур Кельвина (0°С = 273°К) (рис.6.7б).
Кроме того, используется, в основном в США, шкала Форенгейта (рис.6.7в). По этой шкале точки замерзания и кипения воды составляют соответственно 320F и 2120F.
Термометры используются в ограниченном температурном интервале из-за изменения свойств используемых для измерения температуры веществ (например, замерзание и испарение ртути происходит при температурах -390С и +3570С соответственно).

Рис.6.7. Шкалы измерения температуры.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 635; Нарушение авторских прав?; Мы поможем в написании вашей работы!