
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства аминокислот
|
|
|
|
Аминокислоты, их классификация
Состав белков
Функции белков
В растениях белки выполняют разнообразные функции. Важнейшими из них являются каталитическая; запасная; защитная; структурная.
В зависимости от выполняемой в живом организме функции белки делят на несколько классов.
1. Белки-ферменты. Это наиболее многочисленная группа белков. Они катализируют биохимические реакции. С помощью белков-ферментов в живой клетке достигается закономерная последовательность химических превращений веществ.
2. Запасные белки. В больших количествах они накапливаются в клетках зерна и семян при созревании на растении. При прорастании зерна и семян запасные белки гидролизуются до аминокислот, которые затем используются клеткой для формирования нового растения.
3. Защитные белки предохраняют живой организм от разрушения или способствуют его выживанию при повреждении. Растения вырабатывают белки — токсины. Защитная функция их заключается в том, что они защищают растения от поедания их животными, ингибируют протеолитические ферменты насекомых-вредителей, повреждающих семена многих растений.
4. Структурные белки входят в состав покровных тканей растений, семян и плодов. Они составляют также структурную основу биомембран клеток. При этом органеллы клетки сохраняют необходимую последовательность биохимических реакций.
Элементарный состав белков включает углерод, кислород, водород, азот, иногда серу или селен. В состав белков могут входить также железо, медь, цинк, фосфор и некоторые другие элементы.
Например: В составе белка зерна пшеницы содержится: углерода—от 51 до 53 %, кислорода — от 21 до 23, водорода — от 6 до 8, азота —от 16 до 19, серы — от 0,7 до 1,3 %.
Структурными компонентами белков — их мономерами — являются аминокислоты.
Несмотря на то, что в природе известно свыше 150 аминокислот, белки состоят в основном из 20 аминокислот.
Аминокислоты — это соединения, содержащие по крайней мере одну амино- и одну карбоксильную группу. По химическому строению это производные жирных кислот, у которых водород в a-положении замещен на аминную (-NH2) группу. Каждая аминокислота кроме химического имеет тривиальное (традиционное) название. Иногда название происходит от источника, из которого аминокислота была впервые выделена, или ее свойств.
Например: Аспарагиновая кислота — первая аминокислота, открытая в 1806 г., была обнаружена в проростках растения аспарагуса. Глутаминовая кислота — в клейковине пшеницы (в переводе с английского «gluten»—клейковина). Глицин получил свое название за сладкий вкус (от греческого «glykos» — сладкий).
Вот наиболее известные основные аминокислоты:
незаменимые, эссенциальные:
- изолейцин;
- фенилаланин;
- валин;
- лейцин;
- триптофан;
- метионин;
- треонин;
- гистидин;
- лизин;
- аргинин.
- аланин;
- глицин;
- пролин;
- цистеин;
- тирозин;
- серин;
- глутамин;
- аспарагин;
- глутаминовая кислота;
- аспарагиновая кислота.
Существует несколько способов классификации аминокислот, входящих в состав белков. В основу одного из способов классификации положено количество аминных и карбоксильных групп в молекулах. Различают:
1. Моноаминомонокарбоновые кислоты:
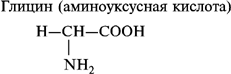

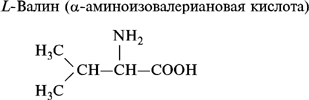
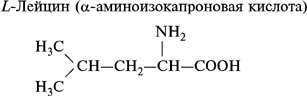
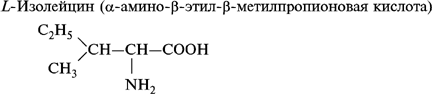
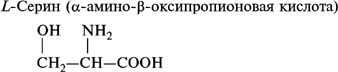
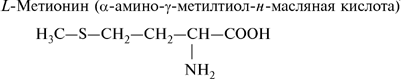
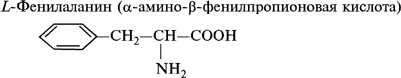
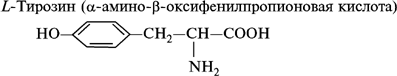
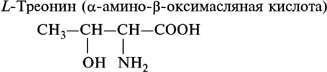

2. Моноаминодикарбоновые аминокислоты:
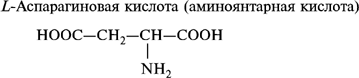
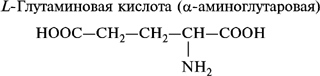
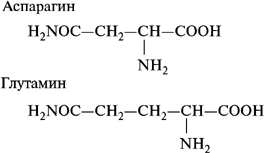
Эти кислоты могут входить в состав белков как в виде кислот, так и в виде амидов: аспарагина и глутамина.
3. Диаминомонокарбоновые аминокислоты:
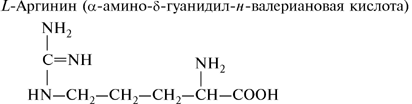
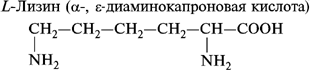
4. Гетероциклические аминокислоты:

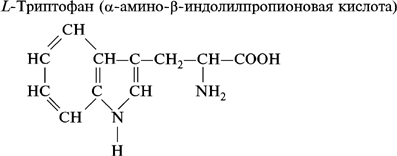
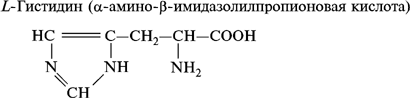
По другой классификации аминокислоты подразделяют в зависимости от химического строения боковой цепи в молекуле аминокислоты на
- алифатические: глицин, аланин, валин, лейцин, изолейцин;
- гидроксиаминокислоты: серин и треонин;
- дикарбоксильные: аспарагиновая и глутаминовая кислоты;
- амиды дикарбоновых аминокислот: аспарагин и глутамин;
- серосодержащие аминокислоты: цистеин и метионин;
- ароматические аминокислоты: фенилаланин, тирозин, триптофан; иминокислоту: пролин.
Также аминокислоты белков принято также делить на три группы в зависимости от состояния аминокислоты — ее электрического заряда, полярности, гидрофобности — при нейтральных рН.
Ф и з и ч е с к и е с в о й с т в а. Аминокислоты представляют собой бесцветные кристаллические вещества. Большинство из них легко растворяются в воде и 80%-ном этаноле. Многие a-аминокислоты обладают сладким вкусом, иногда с некоторым неприятным привкусом.
О п т и ч е с к и е с в о й с т в а. Стереоспецифичность— это характерная особенность живых клеток. Она подтверждает, что трехмерная структура биомолекул имеет чрезвычайно важное значение для их биологических функций. Аминокислоты являются оптически активными соединениями, за исключением глицина. Это объясняется наличием в a-положении асимметрического или хирального атома углерода.
Формы L и D относятся к абсолютной конфигурации аминокислот. Принадлежность к L - или D -ряду определяется взаимным расположением аминной и карбоксильной групп и радикала аминокислот. К L-ряду относят те аминокислоты, у которых атом водорода, карбоксильная и аминная группы находятся по отношению друг к другу по часовой стрелке. К D-ряду относят те аминокислоты, у которых атом водорода, карбоксильная и аминная группы находятся против часовой стрелки:
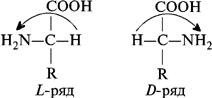
Синтетические аминокислоты являются рацематами, т. е. смесью, состоящей из 50 % L -аминокислот и 50 % D -аминокислот.
Молекулы, имеющие асимметрический атом углерода, способны вращать плоскость поляризованного луча вправо. В этом случае их обозначают знаком (+) или влево — знаком (-). Направление отклонения поляризованного луча зависит от природы растворителя, рН среды и других факторов.
Например: Все встречающиеся в растительных белках аминокислоты принадлежат к L -ряду. D -формы аминокислот не усваиваются организмом человека и животных. D -формы аминокислот встречаются у некоторых антибиотиков.
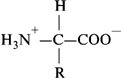
Изоэлектрическая точка. Аминокислоты представляют собой биполярные ионы (внутренние соли). Под действием электрического тока они мигрируют к катоду или аноду (в зависимости от рН среды). Значение рН среды, при которой устанавливается равенство положительных и отрицательных зарядов, называется изоэлектрической точкой. В изоэлектрической точке аминокислоты электрически нейтральны. Например:
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1102; Нарушение авторских прав?; Мы поможем в написании вашей работы!