
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграмма состояния
|
|
|
|
Диаграмма состояния – это графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов в условиях равновесия.
Между тем, следует помнить, что абсолютное отсутствие взаимной растворимости в реальных сплавах не встречается. Компоненты в сплаве обозначают символами их элементов.
Диаграмма состояния позволяет:
- определить для каждого сплава, какие фазы, при каких температурах находятся в равновесии;
- установить состав и количественное соотношение находящихся в равновесии фаз;
- предсказать приблизительно структуру сплава, а иногда определить количественное соотношение структурных составляющих.
Общие закономерности сосуществования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз или законом Гибса.
Правило фаз (или закон Гибса) дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов:
C = K – F + 2,
где (если считать для металлов давление постоянным, т.е. Р - const)
C – число степеней свободы, т.е число внешних (температура и давление) и внутренних (концентрация) факторов, которые можно изменить без изменения числа фаз;
K – число компонентов в системе;
F – число фаз.
Пример: если С = 0, то любое изменение температуры вызывает изменение числа фаз; если С = 1, то возможно изменение температуры без изменения числа фаз.
В жидком состоянии:
F = 1 – одна фаза;
К = 1 – один компонент (чистый металл);
С = 1- 1 + 1 = 1 – можно изменять температуру без изменения агрегатного состояния.
В момент кристаллизации:
F = 2 – две фазы (жидкость + кристаллы)
K = 1 – один компонент (чистый металл);
C = 1 – 2 + 1 = 0 – равновесие при строго определенной температуре (Тпл)
Определив степень свободы для чистого металла и сплава в жидком состоянии и в момент кристаллизации, можно построить кривые нагрева в координатах температура – время (рис.6.1, 6.2).
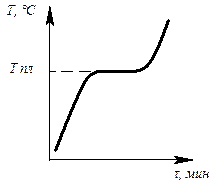
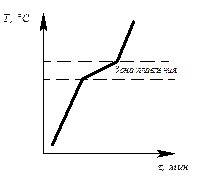
Рис. 6.1. Кривая нагрева Рис. 6.2. Кривая нагрева
чистого металла сплава
Степень свободы для сплава в момент кристаллизации:
F = 2 - две фазы;
K = 2 – два компонента;
С = 2 – 2 + 1.
6.1. Построение диаграмм состояния (равновесия)
Для построения диаграмм состояния, особенно для определения температур затвердевания сплава, используется термический анализ. Для изучения превращений в сплаве в твердом состоянии используют методы физико-химического анализа:
- микроанализ;
- рентгеноструктурный;
- дилатометрический;
- электросопротивления;
- акустический.
Последовательность построения диаграмм термическим методом (компоненты А и В, фазы a, L):
- изготавливают несколько сплавов с известной концентрацией (сплав I, II, III, компоненты А и В) (рис. 6.3);
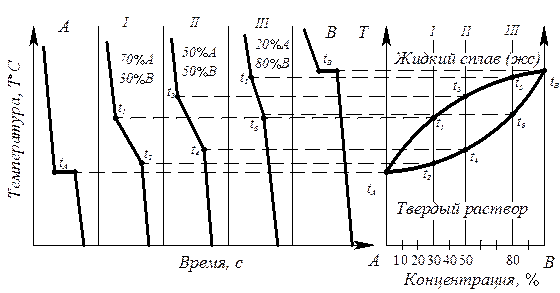
Рис. 6.3. Диаграмма состояния с образованием неограниченных твердых растворов, построенная термическим методом (диаграмма II рода)
- для каждого сплава строят кривые охлаждения в координатах температура – время, по которым определяют температуры начала и конца кристаллизации сплава;
- строят диаграмму состояния в координатах температура – концентрация, где отмечают точки начала и конца кристаллизации, найденные на кривых охлаждения.
Диаграмма состояния получается при соединении критических точек tA, t1, t3, t5, tB, t6, t4, t2, tA плавными кривыми. Полученная кривая tA t1 t3 t5 tB - геометрическое изображение на диаграмме состояния (точка, линия или поверхность) зависимости температур начала кристаллизации (или завершения расплавления) от химического состава сплава. Такая линия называется линия ликвидус. Кривая tA t2 t4 t6 t8 – геометрическое изображение (точка, линия или поверхность) на диагрмме состояния зависимости температуры конца кристаллизации (или начала плавления) от химического состояния сплава Такая линия называется линия солидус.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 530; Нарушение авторских прав?; Мы поможем в написании вашей работы!