
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сахарные кислоты
|
|
|
|
Представителем является D-глюкуроновая кислота, образующаяся от глюкозы.
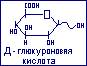
Глюкуроновая кислота является структурным компонентом полисахаридов. Самостоятельно участвует в образовании токсических веществ, образуя с ними водорастворимые глюкурониды, и выводит их с мочой.
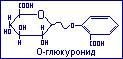
Выведение салициловой кислоты из организма в процессе воздействия лекарственных веществ происходит в виде О-глюкуронида, образующегося по месту полуацетатной гидроксильной глюкуроновой кислоты и фенольного гидроксила салициловой кислоты.
Нейраминовая кислота. Получается в результате альдольной конденсации ПВК и D-аминозамина. (угл22)
Салициловые кислоты. Они являются N-ацетильными производными нейраминовой кислоты. Ацилирование происходит ацетильным или гидроксиацетильным остатком. Например, N-ацетил-D-нейраминовая кислота имеет следующее строение (угл23)
Нейраминовые и сиаловые кислоты в свободном состоянии содержатся в спинномозговой жидкости. Сиаловая кислота является компонентом специфических веществ крови, входит в состав ганглиозидов мозга и участвует в проведении нервных импульсов.
С ложные углеводы
Полисахариды – это высокомолекулярные углеводы, по химической природе относящиеся к полигликозидам, т.е. продуктам поликонденсации моносахаридов, связанные между собой гликозидными связями. Полисахариды имеют большую молекулярную массу и характеризуются высоким уровнем структурной организации макромолекулы. Полисахаридные уепи могут быть разветвлёнными и неразветвлёнными, т.е. линейными.
По составу полисахариды делят на:
1. гомополисахариды – биополимеры, образованные из остатков одного полисахарида
2. гетерополисахариды – образованные из остатков разных моносахаридов.
Все они имеют общее название – гликаны.
Г омополисахариды
К биологически важным относятся крахмал, гликоген, и клетчатка, состоящая из остатков глюкозы.
Крахмал – это смесь двух полисахаридов: амилозы и амилопектина в соотношении 10-20% к 80-90%. Амилоза состоит из остатков  ,D-глюкопиранозы, связанных
,D-глюкопиранозы, связанных  (1
(1 4)-гликозидными связями. В макромолекулу амилазы может включаться от 200 до 1000 остатков общей молекулярной массой 160тыс. единиц. (угл24) Макромолекула амилозы свёрнута в спираль, во внутренний канал которой могут приникать молекулы небольших размеров, образуя комплексы, которые называются “соединения включения”, например, комплекс амилазы с йодом имеет синее окрашивание.
4)-гликозидными связями. В макромолекулу амилазы может включаться от 200 до 1000 остатков общей молекулярной массой 160тыс. единиц. (угл24) Макромолекула амилозы свёрнута в спираль, во внутренний канал которой могут приникать молекулы небольших размеров, образуя комплексы, которые называются “соединения включения”, например, комплекс амилазы с йодом имеет синее окрашивание.
Строение амилопектина.
Амилопектин – гомополисахарид разветвлённой структуры, в составе которого линейная цепь  ,D-глюкопиранозных остатков построена за счёт
,D-глюкопиранозных остатков построена за счёт  (1
(1 4) гликозидных связей, а элементы разветвления формируются за счёт
4) гликозидных связей, а элементы разветвления формируются за счёт  (1
(1 6) гликозидных связей. Между точками разветвления укладывается от 20 до 25 глюкозных остатков; молекулярная масса амилопектина примерно равна 1-6млн. единиц. (угл25)
6) гликозидных связей. Между точками разветвления укладывается от 20 до 25 глюкозных остатков; молекулярная масса амилопектина примерно равна 1-6млн. единиц. (угл25)
Свойства крахмала
Крахмал – это белое аморфное вещество, синтезируемое в растениях в процессе фотосинтеза и запасающееся в клубнях и семенах. Биохимическое превращение сводится к его гидролизу. Гидролиз в живом организме начинается в ротовой полости под действием  -амилазы слюны, где крахмал расщепляется до декстринов. Гидролиз продолжается в тонкой кишке под действием
-амилазы слюны, где крахмал расщепляется до декстринов. Гидролиз продолжается в тонкой кишке под действием  -амилазы поджелудочной железы и заканчивается образованием молекул глюкозы. Схема гидролиза крахмала может иметь следующий вид: (С6Н24О5)n + mН2О,
-амилазы поджелудочной железы и заканчивается образованием молекул глюкозы. Схема гидролиза крахмала может иметь следующий вид: (С6Н24О5)n + mН2О,  -амилаза
-амилаза  декстрины + qН2О, F-гидролиза
декстрины + qН2О, F-гидролиза  мальтоза + Н2О, мальтаза
мальтоза + Н2О, мальтаза  n молекул глюкозы. Глюкоза из кишечника по воротной вене поступает в печень, где участвует в синтезе гликогена, или кровью переносится к различным органам и тканям, где сгорает, выделяя энергию. Уровень глюкозы в норме составляет 3,3-5,0 ммоль/дм3. Качественным реактивом на крахмал и продукты гидролиза является раствор йода. С крахмалом он образует комплекс тёмно-синего цвета. С декстринами – от фиолетового до красно-бурого цвета. Мальтоза и глюкоза раствором йода не окрашиваются.
n молекул глюкозы. Глюкоза из кишечника по воротной вене поступает в печень, где участвует в синтезе гликогена, или кровью переносится к различным органам и тканям, где сгорает, выделяя энергию. Уровень глюкозы в норме составляет 3,3-5,0 ммоль/дм3. Качественным реактивом на крахмал и продукты гидролиза является раствор йода. С крахмалом он образует комплекс тёмно-синего цвета. С декстринами – от фиолетового до красно-бурого цвета. Мальтоза и глюкоза раствором йода не окрашиваются.
Г ликоген или животный крахмал
Гликоген является структурным и функциональным аналогом крахмала. Он содержится во всех животных тканях, особенно много в печени (до20%) и мышцах (до4%). Макромолекула гликогена из-за большого размера не проходит через мембрану, а находится внутри клетки, т.е. в резерве до тех пор, пока не возникает потребность в энергии. Все процессы жизнедеятельности сопровождаются мобилизацией гликогена, т.е. его гидролитическим расщеплением до глюкозы. Молекулярная масса гликогена может достигать 10-12 и даже 1000млн. единиц. Макромолекула строится по принципу амилопектина с той лишь разницей, что участвующих  (1
(1 6) гликозидных связей больше, т.е. гликоген имеет более разветвлённое строение. Сильное разветвление цепи способствует выполнению гликогеном энергетической функции, т.к. при наличии большого числа концевых остатков обеспечивается быстрое отщепление нужного количества молекул глюкозы. С раствором йода гликоген даёт цвет от винно-красного до бурого.
6) гликозидных связей больше, т.е. гликоген имеет более разветвлённое строение. Сильное разветвление цепи способствует выполнению гликогеном энергетической функции, т.к. при наличии большого числа концевых остатков обеспечивается быстрое отщепление нужного количества молекул глюкозы. С раствором йода гликоген даёт цвет от винно-красного до бурого.
К летчатка или целлюлоза
Клетчатка – это структурный гомополисахарид растительного происхождения, являющийся основой опорных тканей растений. Структурной единицей клетчатки является  ,D-глюкопираноза, звенья которой связаны
,D-глюкопираноза, звенья которой связаны  (1
(1 4) гликозидными связями. Макромолекула имеет линейное строение и содержит от 2,5тыс. до 12тыс. глюкозных остатков с общей молекулярной массой 1-2млн. Схема образования: (угл26)
4) гликозидными связями. Макромолекула имеет линейное строение и содержит от 2,5тыс. до 12тыс. глюкозных остатков с общей молекулярной массой 1-2млн. Схема образования: (угл26)
Внутри и между цепями возникают водородные связи, которые обеспечивают высокую механическую прочность, волокнистость, нерастворимость в воде и химическую инертность целлюлозы. Из сложных углеводов только клетчатка не расщепляется в тонком кишечнике из-за отсутствия некоторых ферментов; в толстом кишечнике она частично гидролизуется под действием ферментов микроорганизмов. В процессе пищеварения клетчатка выполняет роль балластного вещества, улучшая перистальтику кишечника.
Г етерополисахариды
Гиалуроновая кислота. Она является полисахаридом соединительной ткани. Её макромолекула строится из остатков дисахаридов, соединённых  (1
(1 4) гликозидными связями. Дисахаридный фрагмент включает остатки D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, соединённых
4) гликозидными связями. Дисахаридный фрагмент включает остатки D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, соединённых  (1
(1 3) гликозидной связью.
3) гликозидной связью. 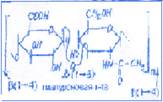 Молекулярная масса полимера достигает 2-7млн. За счёт большого числа карбоксильных групп макромолекулы связывают большое значительное количество воды, поэтому растворы гиалуроновой кислоты оладают повышенной вязкостью. С этим связана её барьерная функция, обеспечивающая непроницаемость соединительной ткани для болезнетворных бактерий. В комплексе с полипептидами гиалуроновая кислота входит в состав стекловидного тела глаза, суставной жидкости, хрящевой ткани.
Молекулярная масса полимера достигает 2-7млн. За счёт большого числа карбоксильных групп макромолекулы связывают большое значительное количество воды, поэтому растворы гиалуроновой кислоты оладают повышенной вязкостью. С этим связана её барьерная функция, обеспечивающая непроницаемость соединительной ткани для болезнетворных бактерий. В комплексе с полипептидами гиалуроновая кислота входит в состав стекловидного тела глаза, суставной жидкости, хрящевой ткани.
Г ликопротеины
Гликопротеины – это смешанные углеводосодержащие биополимеры, в которых белковая молекула связана с углеводами – олигосахаридами. К гликопротеинам относятся ферменты, гормоны, иммуноглобулины и муцины. К этим сложным веществам принадлежат вещества, определяющие групповую специфичность крови. В их основе лежит полипептидная цепь, к которой присоединяются олигосахаридные цепочки (до 55штук). Углеводный компонент и белковая часть связываются гликозидной связью с участием гидроксильных групп аминокислот серина и треонина. В состав углеводного компонента входят N-ацетил-D-галактозамин, N-ацетил-D-глюкозамин, D-галактоза, которые которые распологаются в определённой последовательности от невосстановившегося конца олигосахаридной цепочки (в количестве от 3 до 5). Эта последовательность называется детерминантой, именно она определяет специфичность группы крови. Детерминантным моносахаридом группы крови А служит N-ацетил-D-галактозамин, а группы В - D-галактоза. С изменением детерминанты меняется группа крови.
Муцины – гликопротеины, в небелковой части которой содержится глюкозамин, сиаловая кислота, N-ацетил-D-галактозамин и остаток серной кислоты. Слово “муцины” образовано от греческого mucos – слизь. Муцины входят в состав слюны, яичного белка, секретов кишечника и бронхов. Их присутствие в растворе обеспечивает высокую вязкость среды.
 - аминокислоты. Пептиды
- аминокислоты. Пептиды
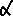 - аминокислоты можно рассматривать как производные карбоновых кислот, в молекуле которых один из атомов водорода замещён аминогруппой. Общее число аминокислот достигает 300, но из них выделяют группу 20-ти наиболее важных
- аминокислоты можно рассматривать как производные карбоновых кислот, в молекуле которых один из атомов водорода замещён аминогруппой. Общее число аминокислот достигает 300, но из них выделяют группу 20-ти наиболее важных  -аминокислот, встречающихся в составе белков животного и растительного происхождения.
-аминокислот, встречающихся в составе белков животного и растительного происхождения.
Общая формула имеет вид: (ак1)
1-кислотный центр, 2-основной центр, 1 и 2 составляют основной фрагмент молекулы, в котором также выделяют хиральный центр, 3 – вариабельный фрагмент молекулы или боковая цепь.
Все  -аминокислоты за исключением глицина (Н2N-CH2-COOH) являются оптически активными веществами,т.к. содержат асимметричный атом углерода и существуют в виде энантиомеров. (ак2) В белках животного происхождения содержатся L-аминокислоты; D-аминокислоты встречаются в белках микроорганизмов. Боковая цепь аминокислот имеет специфический состав и строение для каждой аминокислоты. Кроме углеводородных радикалов боковая цепь может содержать функциональные группы (-ОН, -SH, -COOH, -NH2) и остатки гетероциклов (пятичленный цикл с 2 азотами).
-аминокислоты за исключением глицина (Н2N-CH2-COOH) являются оптически активными веществами,т.к. содержат асимметричный атом углерода и существуют в виде энантиомеров. (ак2) В белках животного происхождения содержатся L-аминокислоты; D-аминокислоты встречаются в белках микроорганизмов. Боковая цепь аминокислот имеет специфический состав и строение для каждой аминокислоты. Кроме углеводородных радикалов боковая цепь может содержать функциональные группы (-ОН, -SH, -COOH, -NH2) и остатки гетероциклов (пятичленный цикл с 2 азотами). 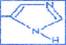 Состав боковой цепи определяет основные физико – химические свойства аминокислот и белков:
Состав боковой цепи определяет основные физико – химические свойства аминокислот и белков:
1. Гидрофильность – т.е. способность полярных группировок боковой цепи к образованию водородных связей с молекулой воды объясняется содержанием в вариабельном фрагменте гидрофильных групп (-ОН, -SH, -COOH, -NH2, [-N=], [-N(H)-]). Способность аминокислот растворяться в воде является главным фактором, с которым связана всасываемость аминокислот и их транспортировка в организме. К гидрофобным группам боковой цепи, снижающим растворимость, относятся углеводородные радикалы и бензольное кольцо.
2. Ионогенность боковой цепи, т.е. способность ионизироваться в водородном растворе, объясняется наличием в её составе ионогенных групп, диссоциирующих по кислотному механизму:
· -СООН  -СОО- + Н+ (боковая цепь приобретает отрицательный заряд)
-СОО- + Н+ (боковая цепь приобретает отрицательный заряд)
· -SH  -S + H+ (боковая цепь приобретает отрицательный заряд)
-S + H+ (боковая цепь приобретает отрицательный заряд)
по основному механизму:
· -NH2 + H+  -NH3+
-NH3+
В водном растворе молекулы аминокислот и белков, как правило, заряжены, и наличие заряда в соответствии с устойчивой гидратной оболочкой является важным фактором, определяющим устойчивость раствора белка.
Кислотно-основные свойства  -аминокислот
-аминокислот
По протеолитической теории кислот и оснований, аминокислоты относятся к амфолитам, т.к. содержат в составе молекулы кислотные и основные центры. В водном растворе молекула аминокислоты существует в виде биполярного иона. (ак3) В сильно кислых средах: (рН=1-2) формируется катионная форма аминокислоты. (ак4)
В сильнощелочной среде: (РН=13-14) преобладает анионная форма аминокислоты. (ак5)
Существуют значения рН специфические для каждой аминокислоты в которой количество анионных форм в растворе равно количеству катионных форм. При этом необходимо учитывать наличие ионогенных группировок боковой цепи. Значение рН при котором общий заряд молекулы аминокислоты равен 0, называется изоэлектрической точкой аминокислоты (pIAK). Если рН раствора соответствует изоэлектрической точке аминокислоты, то при электрофорезе не происходит движения молекулы в растворе. Если рН раствора <pI, то катионная форма аминокислоты движется к катоду. Если рН раствора >pI, то анионная форма аминокислоты движется к аноду. На этом основано разделение аминокислот методом электрофореза. Для большинства белков животного происхождения электрические точки лежат в пределах от 5,5 до 7,0 (исключение: пепсин – pI=1, сильмин – pI=12), т.е. белки обладают более выраженными кислотными свойствами. При физиологических значениях рН=7,34-7,36 in vivo ни одна аминокислота и ни один белок не находится в изоэлектрическом состоянии, а преобладает анионная форма, отрицательный заряд которой уравновешивается катионами натрия и калия.
Химические свойства аминокислот
Аминокислоты – это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбонильных групп, аминокислот, и проявляющие ряд специфических биохимических свойств.
1. Как амфолиты, аминокислоты образуют соли при взаимодействии с кислотами и основаниями (аланин с NaOH = натриевая соль аланина; c HCl = солянокислый аланин). (ак6)
2. Реакция декарбоксилирования аминокислот – это ферментативный процесс образования биогенных аминов из соответствующих  -аминокислот. Декарбоксилирование происходит с участием фермента – декарбоксилазы и кофермента – перидоксаль фосфата. (ак7) Этаноламин участвует в синтезе фосфолипидов. (ак8) Гистамин является медиатором аллергических реакций организма. При декарбоксилировании глутаминовой аминокислоты образуется ГАМК (гамма-аминомаслянная кислота), которая является медиатором торможения нервной системы.
-аминокислот. Декарбоксилирование происходит с участием фермента – декарбоксилазы и кофермента – перидоксаль фосфата. (ак7) Этаноламин участвует в синтезе фосфолипидов. (ак8) Гистамин является медиатором аллергических реакций организма. При декарбоксилировании глутаминовой аминокислоты образуется ГАМК (гамма-аминомаслянная кислота), которая является медиатором торможения нервной системы.
3. Реакция дезаминирования – эта реакция является процессом удаления аминогруппы путём окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования. В организме преобладает путь окислительного дезаминирования с участием ферментов – дегидрогеназ и кофермента – НАД+. На первой стадии процесса осуществляется дегидрирование  -звена с образованием
-звена с образованием  -аминокислоты. На второй стадии происходит неферментативный гидролиз аминокислоты, приводящий к образованию
-аминокислоты. На второй стадии происходит неферментативный гидролиз аминокислоты, приводящий к образованию  -кетокислоты и сопрвождающийся выделением аммиака, включающегося в цикл образования мочевины. (ак9) С помощью подобных процессов снижается уровень аминокислот в клетке.
-кетокислоты и сопрвождающийся выделением аммиака, включающегося в цикл образования мочевины. (ак9) С помощью подобных процессов снижается уровень аминокислот в клетке.
4. Переаминирование или трансаминирование аминокислоты – это путь синтеза необходимых аминокислот из  -кетокислот. При этом донором аминогруппы является
-кетокислот. При этом донором аминогруппы является  -аминокислота, находящаяся в избытке, а акцептором аминогруппа
-аминокислота, находящаяся в избытке, а акцептором аминогруппа  -кетокислоты (ПВК, ЩУК,
-кетокислоты (ПВК, ЩУК,  -кетомаслянная кислота). Процесс происходит с участием фермента – трансаминазы и кофермента – передоксаль фосфата. (ак10) Процесс переаминирования связыавет обмен белков и углеводов в организме, он регулирует содержание аминокилоты и синтез незаменимых
-кетомаслянная кислота). Процесс происходит с участием фермента – трансаминазы и кофермента – передоксаль фосфата. (ак10) Процесс переаминирования связыавет обмен белков и углеводов в организме, он регулирует содержание аминокилоты и синтез незаменимых  -аминокислот.
-аминокислот.
Кроме этих реакций аминокислоты способны образовывать сложные эфиры, азотацитальные производные и всупать в реакции, которые не имеют аналогий в химии in vitro. К таким процессам относится гидроксилирование фенилаланина в тирозин. (ак11)
При отсутствии необходимого фермента в организме накапливается фенилаланин, при его дезаминировании образуется токсическая кислота, накопление которой приводит к тяжёлому заболеванию – фенилкетонурии. Общим свойством  -аминокислот является процесс поликонденсации, приводящий к образованию пептидов. В результате этой реакции формируются амидные связи по месту взаимодействия карбонильных групп одной аминокислоты и аминогрупп другой аминокислоты. В пептидах эта связь называется пептидной связью в составе пептидной группы. (ак12)
-аминокислот является процесс поликонденсации, приводящий к образованию пептидов. В результате этой реакции формируются амидные связи по месту взаимодействия карбонильных групп одной аминокислоты и аминогрупп другой аминокислоты. В пептидах эта связь называется пептидной связью в составе пептидной группы. (ак12)
Последовательность  -аминокислот в составе пептидов и белков определяет их первичную структуру. Если полипептид содержит менее 100 остатков аминокислот, то его называют пептид, более – белок. По месту пептидных связей молекулы белков гидролизуютя in vivo с участием ферментов – пептидаз. Среди пептидаз выделяют:
-аминокислот в составе пептидов и белков определяет их первичную структуру. Если полипептид содержит менее 100 остатков аминокислот, то его называют пептид, более – белок. По месту пептидных связей молекулы белков гидролизуютя in vivo с участием ферментов – пептидаз. Среди пептидаз выделяют:
· Эндопептидазы, расщепляющие связи внутри макромолекулы
· Экзопептидазы, отщепляющие по азоту или углероду концевую аминокислоту
В организме белки расщепляются полностью, т.к. для жизнедеятельности необходимы только свободные аминокислоты. Гидролиз in vivo происходит в сильнокислой или сильнощелочной среде и используется для расшифровки состава белков. В настоящее время расшифрован состав 1500 белков, в том числе ферментов и гормонов. Для высокомолекулярных пептидов и белков характерны более высокие уровни организации молекулы, в проявлении их биохимических свойств важно учитывать пространственное строение, которое определяется пространственным строением пептидной группы. Пептидная группа относится к р,П-сопряжённой системе, в составе которой атомы С,О и N лежат в одной  -плоскости. За счёт образования единого делокализованного 4П-электронного облака вращение вокруг C-N связи затруднено. При этом
-плоскости. За счёт образования единого делокализованного 4П-электронного облака вращение вокруг C-N связи затруднено. При этом  -углеродные звенья находятся в выгодном трансположении.
-углеродные звенья находятся в выгодном трансположении.

В 1950г. Полинг и Корн показали, что наиболее выгодной конформацией полипептидной цепи является правозакрученная  -спираль. Основной вклад в закрепление этой конформации цепи вносят водородные связи, формирующиеся между параллельными участками пептидных групп. Известна другая, вторичная структура белка:
-спираль. Основной вклад в закрепление этой конформации цепи вносят водородные связи, формирующиеся между параллельными участками пептидных групп. Известна другая, вторичная структура белка:  -структура в виде складчатого листа. Кроме водородных связей вторичная структура стабилизируется дисульфидными мостиками по месту цистеиновых остатков.
-структура в виде складчатого листа. Кроме водородных связей вторичная структура стабилизируется дисульфидными мостиками по месту цистеиновых остатков.
Третичная структура является более сложной пространственной организацией макромолекулы, которая стабилизируется водородной связью, дисульфидными мостиками, электростатическими взаимодействиями и силами Ван-дер-Ваальса. По третичной структуре белки делят на:
· Глобулярные – для них характерна  -спиральная структура, уложенная в пространстве в виде сферы – глобулы (например, яичный белок, фермент – глобин в составе гемоглобина)
-спиральная структура, уложенная в пространстве в виде сферы – глобулы (например, яичный белок, фермент – глобин в составе гемоглобина)
· Фибриллярные – для них характерна  -структура. Как правило, эти белки имеют волокнистое строение и к ним относятся белки мышц, ткани – миоинозин,
-структура. Как правило, эти белки имеют волокнистое строение и к ним относятся белки мышц, ткани – миоинозин,  -кератин волос, коллоидные соединения.
-кератин волос, коллоидные соединения.
Четвертичная структура известна для некоторых белков, выполняющих важные физиологические функции. Например, четвертичная структура глобина является пространственным образованием 4-х субъединиц, удерживающих друг около друга гидрофобными связями ориентационного характера. Доказано, что является переносчиком кислорода гемоглобин может только при наличии четвертичной структуры глобина.
В ажнейшие -аминокислоты
-аминокислоты
Белки являются основой структуры и функции живых организмов, т.к. составляют материальную основу химической деятельности клетки. Всё многообразие пептидов и белков построено из  -аминокислотных остатков, которые объединяясь в самой различной последовательности, могут образовывать громадное количество разнообразных белков. Общее количество
-аминокислотных остатков, которые объединяясь в самой различной последовательности, могут образовывать громадное количество разнообразных белков. Общее количество  -аминокислот, входящих в их состав, близко к 70. Среди них выделяют группу из 20 наиболее важных
-аминокислот, входящих в их состав, близко к 70. Среди них выделяют группу из 20 наиболее важных  -аминокислот, постоянно встречающихся во всех белках.
-аминокислот, постоянно встречающихся во всех белках.
Аминокислоты играют важную роль в нормальной жизнедеятельности организма. Недостаток отдельных аминокислот ведёт к нарушению процессов обмена веществ. Так, недостаток триптофана вызывает уменьшение массы тела, дефицит лизина – головокружение, тошноту, повышенную чувствительность к шуму. Недостаток гистидина сопровождается снижением концентрации гемоглобина. В последнее время аминокислоты и их производные нашли широкое применение в лечебной практике, например, метионин – в лечении ряда заболеваний печени, глутаминовая кислота – в некоторых поражениях головного мозга. Наконец, ряд аминокислот и продукты их метаболизма оказывают регулирующее влияние на многие физиологические функции организма.
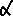 -аминокислоты – гетерофункциональные соединения, представляющие собой производные аминокислот, у которых один водородный атом у
-аминокислоты – гетерофункциональные соединения, представляющие собой производные аминокислот, у которых один водородный атом у  -углеродного звена замещён на аминогруппу.
-углеродного звена замещён на аминогруппу.
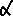 Общая формула
Общая формула  -аминокислот
-аминокислот

Где СООН – кислотная функциональная группа, NH2 – основная функциональная группа, R – радикал (вариабельный фрагмент), пунктиром обозначен общий фрагмент всех  -аминокислот (кроме пролина, в котором эта структура является частью пирромидинового цикла), звёздочкой (*) помечен асимметрический атом углерода – хиральный центр.
-аминокислот (кроме пролина, в котором эта структура является частью пирромидинового цикла), звёздочкой (*) помечен асимметрический атом углерода – хиральный центр.
Для аминокислот характерна стереоизомерия. Асимметричным является  -углеродный атом, т.к. с ним связаны четыре различные химические группы, в этом случае для каждой
-углеродный атом, т.к. с ним связаны четыре различные химические группы, в этом случае для каждой  -аминокислоты существует две возможные конфигурации – D- и L-энантиомеры. В белках встречаются только L-изомеры
-аминокислоты существует две возможные конфигурации – D- и L-энантиомеры. В белках встречаются только L-изомеры  -аминокислот. Это имеет важнейшее значение для формирования пространственной структуры белка и проявления ими биологической активности. С этим непосредственно связана стереоспецифичность действия ферментов. Как видно из общей формулы, аминокислоты отличаются друг от друга химической природой радикала (R), представляющего собой группу атомов, связанную с
-аминокислот. Это имеет важнейшее значение для формирования пространственной структуры белка и проявления ими биологической активности. С этим непосредственно связана стереоспецифичность действия ферментов. Как видно из общей формулы, аминокислоты отличаются друг от друга химической природой радикала (R), представляющего собой группу атомов, связанную с  -углеродным звеном и не участвующую в образовании пептидных связей при синтезе белка. Поэтому всё многобразие особенностей структуры и функции белковых тел связано с химической природой и физико-химическими свойствами радикалов
-углеродным звеном и не участвующую в образовании пептидных связей при синтезе белка. Поэтому всё многобразие особенностей структуры и функции белковых тел связано с химической природой и физико-химическими свойствами радикалов  -аминокислот. Важнейшие
-аминокислот. Важнейшие  -аминокислоты и характеристики их боковых цепей. Порядок названия аминокислоты: сокращённо; строение аминокислот, свойства боковой цепи.
-аминокислоты и характеристики их боковых цепей. Порядок названия аминокислоты: сокращённо; строение аминокислот, свойства боковой цепи.
1. Моноаминокарбоновые:
- глицин ( -аминоуксусная, 2-аминоэтановая); ГЛИ;
-аминоуксусная, 2-аминоэтановая); ГЛИ;  : гидрофобная, неполярная, неионная
: гидрофобная, неполярная, неионная
- аланин ( -аминопропионовая, 2-аминопропановая); АЛА:
-аминопропионовая, 2-аминопропановая); АЛА:  гидрофобная, неполярная, неионная.
гидрофобная, неполярная, неионная.
- валин ( -амино-
-амино- -метилмаслянная, 2-амино-3-метилбутановая); ВАЛ:
-метилмаслянная, 2-амино-3-метилбутановая); ВАЛ: 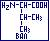 гидрофобная, неполярная, неионная.
гидрофобная, неполярная, неионная.
- лейцин ( -амино-
-амино- -метилвалериановая): ЛЕЙ;
-метилвалериановая): ЛЕЙ; 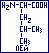 гидрофобняа, неполярная, неионная.
гидрофобняа, неполярная, неионная.
- изолейцин ( -аино-
-аино- -метилвалериановая): ИЛЕ:
-метилвалериановая): ИЛЕ: 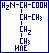 гидрофобняа, неполярная, неионная.
гидрофобняа, неполярная, неионная.
2. Моноаминодикарбоновые:
- аспарагиновая ( -аминоянтарная, 2-аминобутандиовая); АСП:
-аминоянтарная, 2-аминобутандиовая); АСП: 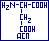 гидрофильная, полярная, ионная (-СН2-СОО-).
гидрофильная, полярная, ионная (-СН2-СОО-).
- глутаминовая ( -аминоглутаровая, 2-аминопнтадиовая); ГЛУ:
-аминоглутаровая, 2-аминопнтадиовая); ГЛУ: 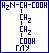 гидрофильная, полярная, ионная (-СН2-СОО-).
гидрофильная, полярная, ионная (-СН2-СОО-).
3. Диаминомонокарбоновые:
- лизин ( ,
, -диаминокапроновая, 2,6-диаминокексановая); ЛИЗ:
-диаминокапроновая, 2,6-диаминокексановая); ЛИЗ:  гидрофильная, полярная, ионная (-СН2-NH3+)
гидрофильная, полярная, ионная (-СН2-NH3+)
- аргинин ( -амино-
-амино- -гуанидиновалериановая); АРГ:
-гуанидиновалериановая); АРГ: 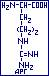 гидрофильная, полярная, ионная (-CH3-NH-C(NH2)=NH2+).
гидрофильная, полярная, ионная (-CH3-NH-C(NH2)=NH2+).
4. Оксиаминокислоты:
- серин ( -амино-
-амино- -оксипропионовая); СЕР: (АКМ11) гидрофильная, полярная, неионная
-оксипропионовая); СЕР: (АКМ11) гидрофильная, полярная, неионная
- треонин ( -амино-
-амино- -оксимаслянная) ТРЕ: (АКМ12) гидрофильная, полярная, неионная
-оксимаслянная) ТРЕ: (АКМ12) гидрофильная, полярная, неионная
5. Серосодержащие:
- цистеин ( -амино-
-амино- -тиопропионовая); ЦИС: (АКМ13) гидрофильная, полярная, ионная (-CH2-S-).
-тиопропионовая); ЦИС: (АКМ13) гидрофильная, полярная, ионная (-CH2-S-).
- цистин (ди- -амино-
-амино- -тиопропионовая (производное цистина)); ЦИС-S-S-ЦИС: (АКМ14) гидрофобная, неполярная, неионная.
-тиопропионовая (производное цистина)); ЦИС-S-S-ЦИС: (АКМ14) гидрофобная, неполярная, неионная.
- метионин ( -амино-
-амино- -метилтиомаслянная); МЕТ: (АКМ15) гидрофобная, неполярная, неионная.
-метилтиомаслянная); МЕТ: (АКМ15) гидрофобная, неполярная, неионная.
6. Ароматические:
- фенилаланин ( -амино-
-амино- -фенилпропионовая); ФЕН: (АКМ16) гидрофобная, неполярная, неионная.
-фенилпропионовая); ФЕН: (АКМ16) гидрофобная, неполярная, неионная.
- тирозин ( -амино-
-амино- -пираоксифенилпропионовая); ТИР: (АКМ17) гидрофильная, полярная, ионная (-СН2-С6Н4-О-).
-пираоксифенилпропионовая); ТИР: (АКМ17) гидрофильная, полярная, ионная (-СН2-С6Н4-О-).
7. Гетероциклические:
- гистидин ( -амино-
-амино- -имидазолилпропионовая); ГИС: (АКМ18) гидрофильная, полярная, ионная
-имидазолилпропионовая); ГИС: (АКМ18) гидрофильная, полярная, ионная
- триптофан ( -амино-
-амино- -индолилпропионовая); ТРИ: (АКМ19) гидрофобная, неполярная, неионная.
-индолилпропионовая); ТРИ: (АКМ19) гидрофобная, неполярная, неионная.
Особое место среди гетероциклических  -аминокислот занимают пролин и его гидроксипроизводные, являющиеся аминокислотами. В них
-аминокислот занимают пролин и его гидроксипроизводные, являющиеся аминокислотами. В них  -аминокислотный фрагмент входит только в состав пиррамидинового цикла.
-аминокислотный фрагмент входит только в состав пиррамидинового цикла.
Пролин: ПРО: (АКМ20) гидрофобная, неполярная, неионная.
Оксипролин: ОПР: (АКМ21) гидрофобная, неполярная, неионная.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1517; Нарушение авторских прав?; Мы поможем в написании вашей работы!