
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства спиртов
|
|
|
|
В молекуле спирта можно выделить три реакционных центра
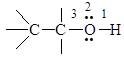
1) О-Н-связь: обладает выраженной полярностью вследствие высокой электроотрицательности кислорода по сравнению с водородом, реакции с разрывом О-Н-связи определяют кислотность спирта;
2) неподеленная электронная пара атома кислорода определяет основность и нуклеофильность спирта;
3) С-О-связь: также обладает полярностью из-за различия электроотрицательности кислорода и углерода, разрыв С-О-связи характерен для реакций нуклеофильного замещения и β-элиминирования
В соответствии с перечисленными реакционными центрами для спиртов можно выделить следующие реакции:
1. Кислотно-основные
2. Нуклеофильное замещение гидроксильной группы
3. Дегидратация спиртов
4. Окисление спиртов.
1. Кислотные и основные свойства спиртов. Спирты способны проявлять себя как кислоты и как основания. Константа диссоциации этанола Ка (рКа =10-16) в 1010 раз выше, чем Ка ацетилена (рКа =10-26).
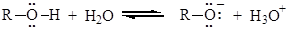
В силу своих кислотных свойств спирты легко взаимодействуют со щелочными металлами, образуя соли (алкоголяты):
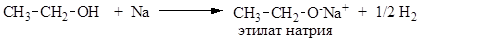
Кислотность спиртов определяется строением алкильного радикала. Так, кислотность в ряду низших спиртов меняется следующим образом:
Н2О (рКа=15.7) > CH3OH (pKa=11.2) > CH3CH2OH (pKa=15.8) > (CH3)2CHOH (pKa=16.9) > (CH3)3COH(pKa=19.2)
Наименьшую кислотность имеет трет -бутиловый спирт, так как соответствующий алкоксид-анион наименее устойчив из-за электронодонорного влияния метильных групп:
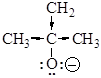
Основные свойства спиртов проявляются по отношению к протонным и апротонным кислотам. Донором электронов в молекуле спирта является атом кислорода:
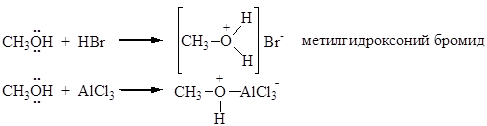
Основность спиртов изменяется в ряду: (CH3)3COH > (CH3)2CHOH > CH3CH2OH > CH3OH
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 504; Нарушение авторских прав?; Мы поможем в написании вашей работы!