
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 1. Определить для серной кислоты: 1) относительную молекулярную массу Мr; 2) молярную массу М
|
|
|
|
Пример 1. Определить для серной кислоты: 1) относительную молекулярную массу Мr; 2) молярную массу М.
Решение. 1. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, атомы которых входят в состав молекулы данного вещества, и определяется по формуле
 (1)
(1)
где ni — число атомов i -гo элемента, входящих в молекулу; Аr , i — относительная атомная масса i -го элемента. Химическая формула серной кислоты имеет вид H2SO4. Так как в состав молекулы серной кислоты входят атомы трех элементов, то стоящая в правой части равенства (1) сумма будет состоять из трех слагаемых и эта формула примет вид
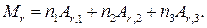 (2)
(2)
Из формулы серной кислоты далее следует, что n 1 = 2 (два атома водорода), n 2 = 1 (один атом серы) и n 3 = 4 (четыре атома кислорода).
Значения относительных атомных масс водорода, серы и кислорода найдем в таблице Д. И. Менделеева или в табл. 14 Приложения:
Аr ,1 = l, Аr ,2 = 32, Аr ,3 = 16.
Подставив значения ni и Аr , i в формулу (2), найдем относительную молекулярную массу серной кислоты:
Mr = 2∙1 + 1∙32 + 4∙16 = 98.
2. Зная относительную молекулярную массу Мr, найдем молярную массу серной кислоты по формуле
М = Mrk, (3)
где k = 10–l кг/моль.
Подставив в (3) значения величии, получим
М = 98∙10–3 кг/моль.
Пример 2. Определить молярную массу М смеси кислорода массой m 1 = 25 г и азота массой m 2 = 75 г.
Решение. Молярная масса смеси М есть отношение массы смеси т к количеству вещества смеси ν:
М = m/ν. (1)
Масса смеси равна сумме масс компонентов смеси:
т = т 1 + m 2.
Количество вещества смеси равно сумме количеств вещества компонентов:
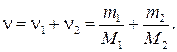
Подставив в формулу (1) выражения т и ν,получим
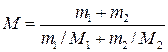 (2)
(2)
Применив метод, использованный в примере 1, найдем молярные массы кислорода M 1 и азота M 2:
М 1 = 32∙10–3 кг/моль; М2 = 28∙10–3 кг/моль.
Подставим значения величии в (2) и произведем вычисления:
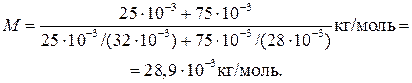
Пример 3. Определить число N молекул, содержащихся в объеме V = l мм3 воды, и массу т 1 молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекул.
Решение. Число N молекул, содержащихся в некоторой системе массой m, равно произведению постоянной Авогадро N A на количество вещества ν:
N = ν N A.
Так как ν = m/M, где М — молярная масса, то 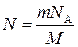 . Выразив в этой формуле массу как произведение плотности на объем V, получим
. Выразив в этой формуле массу как произведение плотности на объем V, получим
N = ρ VN A /M.
Произведем вычисления, учитывая, что М = 18∙10–3 кг/моль (см. табл. 14 Приложения):
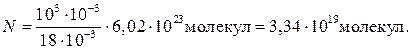
Массу m 1 одной молекулы можно найти по формуле
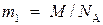 (1)
(1)
Подставив в (1) значения М и N a, найдем массу молекулы воды:
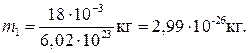
Если молекулы воды плотно прилегают друг к другу, то можно считать, что на каждую молекулу приходится объем (кубическая ячейка) V 1 = d 3, где d — диаметр молекулы. Отсюда
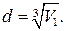 (2)
(2)
Объем V 1 найдем, разделив молярный объем V m на число молекул в моле, т. е. на N a:
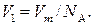 (3)
(3)
Подставим выражение (3) в (2):
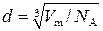 ,
,
где V m = M / ρ. Тогда
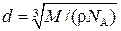
Проверим, дает ли правая часть выражения (4) единицу длины:
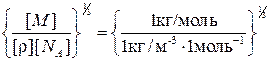
Произведем вычисления:
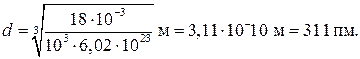
Пример 4. В баллоне объемом 10 л находится гелий под давлением р 1 = 1 МПа и при температуре T = 300 К. После того как из баллона было взято m = 10г гелия, температура в баллоне понизилась до T = 290 К. Определить давление р 2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева—Клапейрона, применив его к конечному состоянию газа:
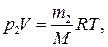 (1)
(1)
где m 2 — масса гелия в баллоне в конечном состоянии; М — молярная масса гелия; R — молярная газовая постоянная.
Из уравнения (1) выразим искомое давление:
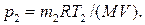
Массу m 2 гелия выразим через массу т 1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
m 2 = m 1 – m.
Массу m 1 гелия найдем также из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
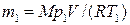 . (4)
. (4)
Подставив выражение массы m 1 в (3), а затем выражение т 2 в (2), найдем
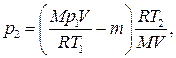
или
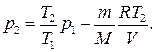 (5)
(5)
Проверим, дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых (T 2/ T 1) — безразмерный, а второй — давление. Проверим второе слагаемое:
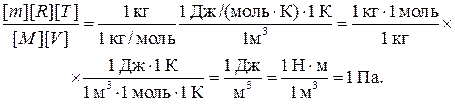
Паскаль является единицей давления. Произведем вычисления по формуле (5), учитывая, что М = 4∙10–3 кг/моль (см. табл. 14 Приложения):
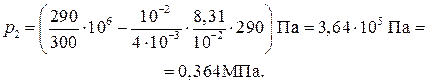
Пример 5. Баллон содержит m 1 = 80 г кислорода и m 2 = 320 г аргона. Давление смен р = 1 МПа, температура T = 300К. Принимая данные газы за идеальные, определить объем V баллона.
Решение По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Менделеева — Клапейрона, парциальные давления р 1 кислорода и р2 аргона выражаются формулами
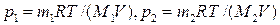 .
.
Следовательно, по закону Дальтона, давление смеси газов
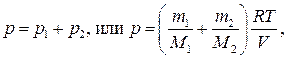
откуда объем баллона
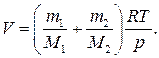
Произведем вычисления, учитывая, что M 1 = 32∙10–3 кг/моль, М 2 = 40∙10–3 кг/моль (см. табл. 14 Приложения):
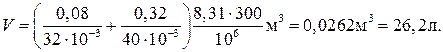
Пример 6. Найти среднюю кинетическую энергию 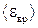 вращательного движения одной молекулы кислорода при температуре T = 350 К, а также кинетическую энергию Е к вращательного движения всех молекул кислорода массой m = 4г.
вращательного движения одной молекулы кислорода при температуре T = 350 К, а также кинетическую энергию Е к вращательного движения всех молекул кислорода массой m = 4г.
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя энергия 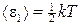 , где k — постоянная Больцмана; Т — термодинамическая температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода — двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
, где k — постоянная Больцмана; Т — термодинамическая температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода — двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
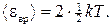 (1)
(1)
Кинетическая энергия вращательного движения всех молекул газа
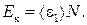 (2)
(2)
Число всех молекул газа
N = N aν, (3)
где N A — постоянная Авогадро; ν — количество вещества. Если учесть, что количество вещества ν =m / M, где m — масса газа; М — молярная масса газа, то формула (3) примет вид
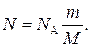
Подставив выражение N в формулу (2), получаем
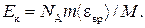 (4)
(4)
Произведем вычисления, учитывая, что для кислорода M = 32∙10–3 кг/моль (см. табл. 14 Приложения):
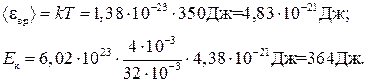
Пример 7. Вычислить удельные теплоемкости при постоянном объеме cV и при постоянном давлении ср неона и водорода, принимая эти газы за идеальные.
Решение. Удельные теплоемкости идеальных газов выражаются формулами
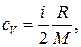 (1)
(1)
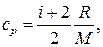 (2)
(2)
где i — число степеней свободы молекулы газа; М — молярная масса. Для неона (одноатомный газ) i = 3 и М = 20∙10–3 кг/моль (см. табл. 14 Приложения). Произведем вычисления:

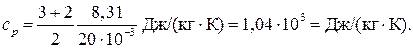
Для водорода (двухатомный газ) i = 5 и М = 2∙10–3 кг/моль. Тогда
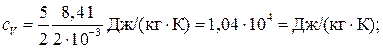
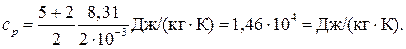
Пример 8. Вычислить удельные теплоемкости сV и с p смеси неона и водорода, если массовые доли неона и водорода составляют w 1 = 80% и w 2 = 20%. Значения удельных теплоемкостей газов взять из предыдущего примера.
Решение. Удельную теплоемкость cV смеси при постоянном объеме найдем следующим образом. Теплоту, необходимую для нагревания смеси на Δ T выразим двумя способами:
Q = cV (m 1 + m 2)Δ T, (1)
Q = (cV ,1 m 1 + cV ,2 m 2)Δ T, (2)
где cV ,1 — удельная теплоемкость неона; cV ,2 — удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на Δ T, получим cV (m 1 + m 2) = cV ,1 m 1 + cV ,2 m 2. Отсюда
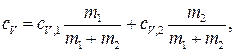
или
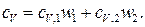
где 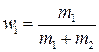 и
и 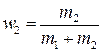 .
.
Рассуждая так же, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
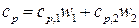
Произведем вычисления:
сV = (6,24∙102∙0,8 + 1,04∙104.0,2) Дж/(кг∙К) =
= 2,58∙103 Дж/(кг∙К) = 2,58 кДж/(кг∙К);
ср = (1,04∙103∙0,8 + 1,46∙104∙0,2) Дж/(кг∙К) =
= 3,75∙103 Дж/(кг∙К) = 3,75 кДж/(кг∙К).
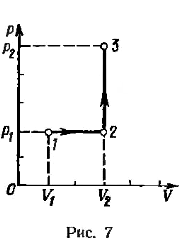
Пример 9. Кислород массой m = 2 кг занимает объем V 1 = l м3 и находится под давлением р 1 = 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V 2 = 3 м, а затем при постоянном объеме до давления р 3 = 0,5 МПа. Найти изменение Δ U внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
Решение. Изменение внутренней энергии газа
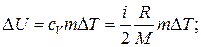 (1)
(1)
где i — число степеней свободы молекул газа (для двухатомных молекул кислорода i = 5); Δ Т = Т 3 — Т 1 — разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из уравнения Менделеева — Клапейрона 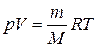 , откуда
, откуда
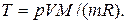
Работа расширения газа при постоянном давлении выражается формулой
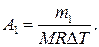
Работа газа, нагреваемого при постоянном объеме, равна нулю:
A 2 = 0.
Следовательно, полная работа, совершаемая газом,
A = A 1 + A 2 = A 1.
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии Δ U и работы А:
Q = Δ U + A.
Произведем вычисления, учтя, что для кислорода М = 32∙10–3 кг/моль (см. табл. 14 Приложения):
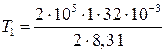 К = 385 К;
К = 385 К;
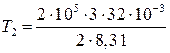 К = 1155;
К = 1155;
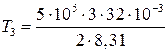 К = 2887;
К = 2887;
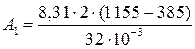 Дж = 0,400∙106 Дж = 0,4 МДж;
Дж = 0,400∙106 Дж = 0,4 МДж;
А = А 1 = 0,4 МДж;
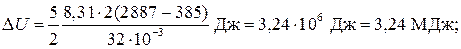
Q = (3,24 + 0,4) МДж = 3,64 МДж.
График процесса приведен на рис. 7.
 Пример 10. В цилиндре под поршнем находится водород массой m = 0,02 кг при температуре T 1 = 300 К. Водород сначала расширился адиабатно, увеличив свой объем в п 1 = 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n 2 = 5 раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах. Изобразить процесс графически.
Пример 10. В цилиндре под поршнем находится водород массой m = 0,02 кг при температуре T 1 = 300 К. Водород сначала расширился адиабатно, увеличив свой объем в п 1 = 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n 2 = 5 раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
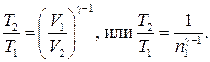
где γ — отношение теплоемкостей газа при постоянном давлении и постоянном объеме; n 1 = V 2/ V 1.
Отсюда получаем следующее выражение для конечной температуры:
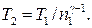
Работа А 1 газа при адиабатном расширении может быть определена по формуле
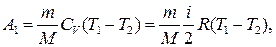
где CV — молярная теплоемкость газа при постоянном объеме. Работа А 2 газа при изотермическом процессе может быть выражена в виде
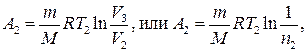
где п 2 = V 2/ V 3.
Произведем вычисления, учитывая, что для водорода как двухатомного газа γ = 1,4, i = 5 и М = 2∙10–3 кг/моль:
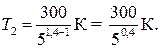
Так как 50,4 = 1,91 (находится логарифмированием), то
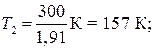
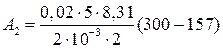 Дж = 29,8кДж;
Дж = 29,8кДж;
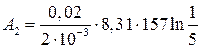 Дж = –21 кДж.
Дж = –21 кДж.
Знак минус показывает, что при сжатии работа газа совершается над газом внешними силами.
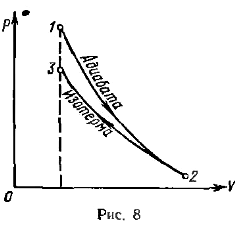 График процессе приведен на рис. 8.
График процессе приведен на рис. 8.
Пример 11. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика T 1 = 500 К. Определить термический КПД η цикла и температуру Т 2 теплоприемника тепловой машины, если за счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу А = 350 Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, превращается в механическую работу. Термический КПД выражается формулой
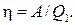
где Q 1 — теплота, полученная от теплоотдатчика; А — работа, совершенная рабочим телом тепловой машины. Зная КПД цикла, можно по формуле η = (Т 1 — T 2) /T 1 определить температуру охладителя Т 2:
T 2 = T 1 (1 — η).
Произведем вычисления:
η = 350/1000 = 0,35; T 2 = 500(1 —0,35) К = 325 К.
Пример 12. Найти добавочное давление внутри мыльного пузыря диаметром d = 10 cм. Какую работу нужно совершить, чтобы выдуть этот пузырь?
Решение. Пленка мыльного пузыря имеет Две сферические поверхности: внешнюю и внутреннюю. Обе поверхности оказывают давление на воздух, заключенный внутри пузыря. Так как толщина пленки чрезвычайно мала, то диаметры обеих поверхностей практически одинаковы. Поэтому добавочное давление
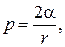
где r — радиус пузыря. Так как r = d/ 2, то
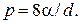
Работа, которую нужно совершить, чтобы, растягивая пленку, увеличить ее поверхность на ΔS, выражается
формулой
A = αΔ S, или A = α(S — S 0).
В данном случае S — общая площадь двух сферических поверхностей пленки мыльного пузыря; S 0 — общая площадь двух поверхностей плоской пленки, затягивавшей отверстие трубки до выдувания пузыря. Пренебрегая S 0, получаем
A = α S = 2π d 2α.
Произведем вычисления:
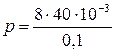 Па = 3,2 Па;
Па = 3,2 Па;
A = 2∙3,14∙(0,1)2∙40∙10–3 Дж = 2,5∙10–3 Дж = 2,5 мДж.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 651; Нарушение авторских прав?; Мы поможем в написании вашей работы!